Science综述:通过肠-脑轴传递炎症信号
时间 : 2021-11-30
2021年11月26日,来自美国加州大学洛杉矶分校的Elaine Y. Hsiao及其团队在Science (IF: 41.845)杂志上发表名为Signaling inflammation across the gut-brain axis的研究
穿过肠脑轴的炎症分子
胃肠道暴露于食物和环境抗原以及固有肠道微生物群及其分子副产品。有三种物理屏障协同工作,以避免管腔内容物不受控制地进入下层固有层和血流:由杯状细胞产生的厚黏液层、半透性单层肠细胞和由内皮细胞、周细胞和肠神经胶质细胞组成的肠血管屏障 (GVB)。此外,肠道容纳了体内最大数量的免疫细胞群,它们可积极地观察官腔环境。
穿过肠-脑轴的炎性信号
肠-脑轴涉及双向和连续的对话,以告知分子细胞和功能状态。在胃肠道和中枢神经系统之间,可以采用三个平行但相互连接的通信路径来传递炎症信号 (图1)。
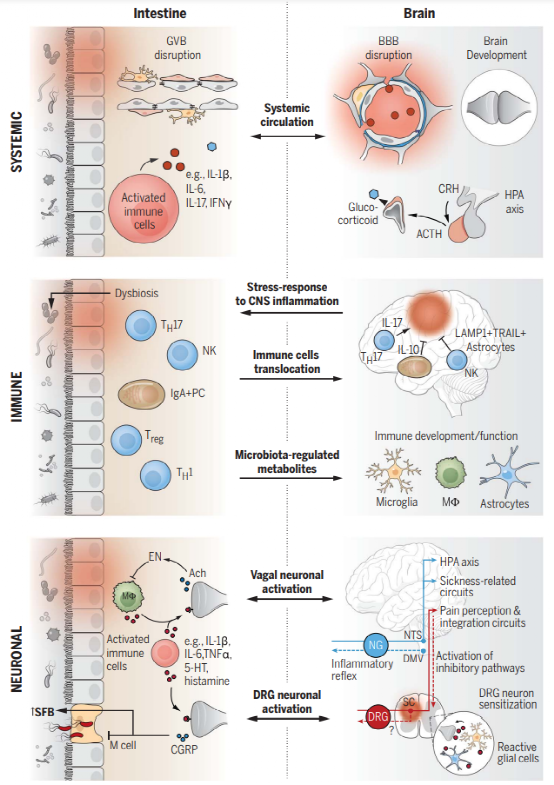
图1. 穿过肠-脑轴的炎症信号通路
全身循环系统-体液通路
由局部感染、菌群失调或食物抗原引发的肠道炎症会诱导促炎细胞因子的释放,如IFN-γ、IL-1β、IL-6和TNF-α,以及其他免疫因子,如果不加以控制,这些因子可能会产生严重的肠道外后果。循环中的促炎因子可以破坏上皮紧密连接,损害GVB和血脑屏障的完整性。肠道通透性增加或肠漏,加上中枢神经系统屏障的破坏,为肠腔源性分子、毒素和病原体到达脑实质,激活局部免疫细胞和触发神经炎症提供了通道。例如,细菌壁组分脂多糖 (LPS)的系统水平升高与小胶质细胞激活、神经元细胞死亡、认知障碍和细胞因子介导的疾病行为 (运动性降低、食物摄入量减少和社会退缩)相关。一些神经系统疾病与肠道通透性增加有关,微生物群依赖性肠屏障功能恢复可改善小鼠的某些行为异常。肠道微生物群及其副产品除了对肠道通透性产生局部影响外,还在中枢神经系统中发挥直接的神经免疫调控作用。小胶质细胞、星形胶质细胞和边界相关巨噬细胞的发育、成熟和功能受到微生物依赖信号的调节。
下丘脑-垂体-肾上腺 (HPA)轴的活动是迄今为止记录的肠-脑轴的主要传出体液臂。环境应激源或肠道炎症的外周反应整合到中枢神经系统中,触发HPA轴,协调肾上腺糖皮质激素的释放。这种强效应激诱导激素可通过调控肠道免疫细胞活性、肠道功能和微生物组成来恢复体内平衡或促进胃肠道功能紊乱。应激诱导的失调反过来可以通过TH17细胞依赖性释放IL-17A引发肠道炎症,这有助于应激反应的前馈激活。肠道微生物群也参与了稳态过程中调控HPA轴,因为微生物群缺乏会加剧HPA对中度应激源的反应活性。引流脑脊液的脑膜淋巴管可能是分子从中枢神经系统进入外周的另一条通路,以刺激或启动外周器官 (包括胃肠道)的免疫反应。然而,这种通路在肠-脑交流中的作用仍然是假设性的,需要进一步的证据。
炎症相关疾病中的肠脑交流
与共病性肠道炎症和促炎血清学特征 (与脑和行为损伤相关)一起出现的几种神经系统疾病包括认知能力下降,自闭症谱系障碍 (ASD)和肥胖的神经行为症状 (图2)。与老龄化相关的认知能力下降与慢性低度肠道和中枢炎症状态相关,包括中枢神经系统中小胶质细胞、T细胞和边缘相关巨噬细胞的增加以及肠道微生物群的改变。衰老相关B细胞也从外周侵入脑膜并分化为产生IgM的浆细胞。值得注意的是,肠道菌群失调在中枢神经系统免疫改变之前引起肠道通透性,并诱发神经炎症症状,这表明肠道菌群失调有利于炎症因子通过肠-脑轴的体液信号传导。
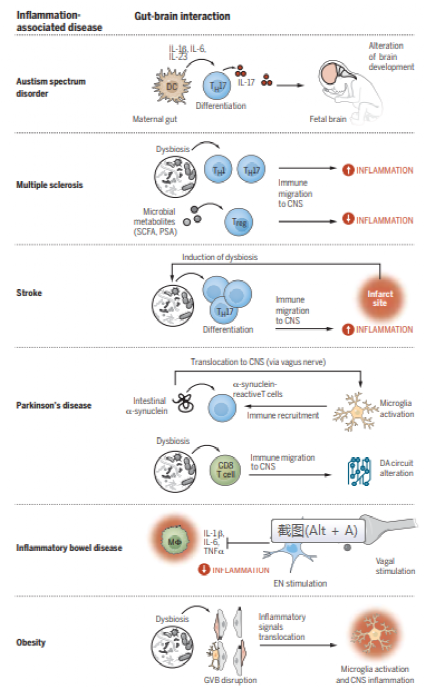
图2. 炎症相关疾病中的肠-脑轴
结论及展望
炎症信号通过肠-脑轴的双向传递,对于调控炎症相关疾病的生理行为和病理具有重要意义。在传入方向上,肠道免疫细胞可以被招募到大脑中,但最初感觉到的炎症信号及其在大脑中的作用机制尚不清楚。大脑如何在传出方向调控肠道炎症尚不清楚。除了ANS功能障碍外,通过传出迷走神经细胞发出信号,通过脑膜淋巴管将脑源性循环因子运输到外周,以及通过HPA轴的间接相互作用都是这种通信的潜在途径。肠道菌群是肠-脑轴中免疫细胞的关键调控因子,而生物失调与多种炎症相关疾病和风险因素有关,包括衰老、饮食和压力。然而,生物失调是否在第二种情况下起因果作用是一个开放的问题。确定特定的肠道微生物抗原和代谢物影响肠道免疫细胞或可能通过血脑屏障影响中枢神经系统细胞的机制将有助于解决这个问题。我们还应该考虑到肠道微生物群对环境条件变化的响应性。因此,微生物依赖性的肠-脑信号调控的变化可能是肠道、神经免疫和行为症状严重程度差异的基础,在不同设施中饲养的小鼠模型中,这使得研究结果的转换具有挑战性。解读肠-脑轴炎症信号的基本机制对于我们理解神经免疫通信至关重要,并且应该促进GI和神经系统疾病免疫调节治疗的发展。



