Nature子刊:报道了结肠炎转变为结肠癌的新机制
时间 : 2020-12-22
2020年12月以色列雷霍沃特魏兹曼科学研究所生物分子科学系Ruth Scherz-Shouval于Nature communications发表文章Heat Shock Factor 1-dependent extracellular matrix remodeling mediates the transition from chronic intestinal inflammation to colon cancer其研究证明HSF1依赖的ECM重塑在介导炎症驱动的结肠癌中起着至关重要的作用。

结直肠癌(CRC)是世界范围内与癌症相关的死亡的主要原因之一。CRC通常是由遗传和环境因素共同导致的,导致发育异常的病变并最终导致癌变。CRC的一种特别具有侵略性的亚型是结肠炎相关的结肠癌(CAC),由于长期暴露于慢性炎症而引起于炎症性肠病(IBD)患者。比零星CRC的腺瘤发育不良-癌症进展不同,CAC从体细胞突变的累积开发从发炎的粘膜发育异常至癌居间进展。CAC中的基因组改变谱不同于散发的CRC,即TP53,IDH1中的改变与散发CRC中报道的结果相比,CAC中MYC和MYC的发生率显着更高,而APC中的突变的发生率则显着降低。无论是起始和CAC的进展是由炎性损伤加急。此类炎症信号是通过癌细胞与肿瘤微环境(TME)细胞之间的动态串扰介导的。TME包括各种类型的非恶性基质细胞,包括巨噬细胞,嗜中性粒细胞,淋巴细胞,内皮细胞和癌症相关的成纤维细胞(CAF)。
成纤维细胞是正常结肠的主要成分,在那里它们通常处于静止状态,并具有维持ECM完整性和限制上皮细胞增殖和分化的功能。成纤维细胞提供纤维和连接蛋白,赋予组织结构,并通过表达和分泌可变的结构蛋白产生专门的ECM 。在严重受伤或慢性发炎组织,成纤维细胞产生过量的ECM,其中,没有往复平衡恶化,导致纤维化和最终可以导致癌症。与癌细胞共同进化,肿瘤中的成纤维细胞被募集并重新布线,成为致瘤性CAF,可通过分泌细胞因子,趋化因子和生长因子支持恶性肿瘤的关键方面。CAFs从正常成纤维细胞分泌的那些中分泌出独特的基质成分和重塑酶,导致异常的ECM组成和形貌,从而增加了肿瘤的硬度并促进了肿瘤的侵袭和进展。此外,CAF分泌的蛋白酶会裂解并激活ECM中嵌入的生长因子,细胞因子和细胞粘附分子(CAM),从而增加癌细胞的运动性和EMT 。与癌细胞不同,CAF在基因组上是稳定的,并且不包含可驱动其共同进化和功能重编程的致癌突变。取而代之的是,基质的重编程是通过大量的转录来实现重新布线。
热休克因子1(HSF1),热休克反应的主调节器,使成纤维细胞转录重新布线成致瘤性CAF 。历史上一直在热应力的背景下研究HSF1。当发现Hsf1无效的小鼠对肿瘤发生极有抵抗力时,就确立了在癌症中的关键作用。这种现象最初主要归因于HSF1的活动在肿瘤细胞 ; 然而,HSF1互补至关重要的作用,最近证明的CAF。基质HSF1程序从程序HSF1驱动器在相邻的癌细胞完全不同的或在热震期间。与癌细胞的成纤维细胞共培养的HSF1驱动参与粘附和伤口愈合的基因的表达,从而导致在相邻的癌细胞参与ECM组织的基因的活化。这是一种基本的生存机制,似乎已经被颠覆以非细胞自主方式支持正在生长的肿瘤。
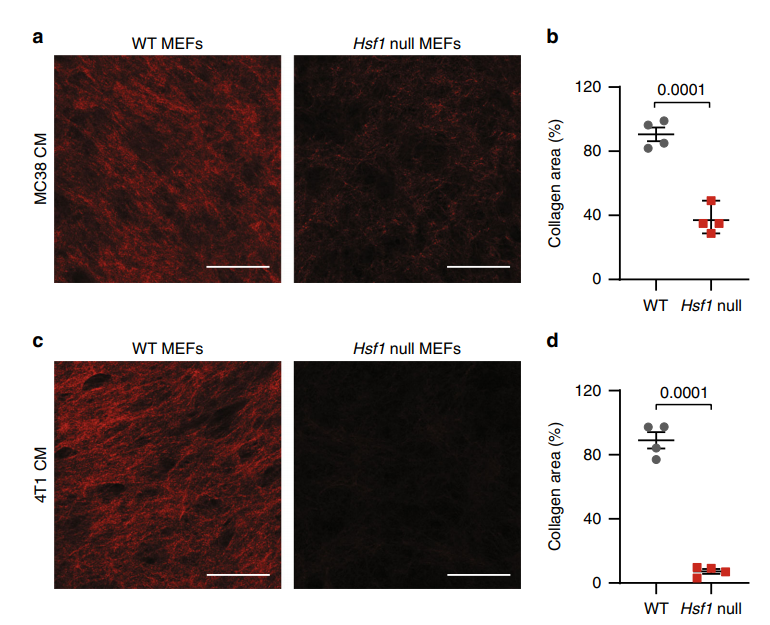
图1:HSF1缺失阻碍成纤维细胞胶原纤维沉积
作为一种生存因子,HSF1先前已显示在小鼠的急性结肠炎中起保护作用。当暴露于一个疗程的硫酸葡聚糖钠(DSS)治疗(7天)时,与野生型(WT)相比,Hsf1无效的小鼠表现出更严重的结肠炎形式。HSF1的作用是通过热休克蛋白(HSP)70介导的,并涉及促炎细胞因子和CAMs的抑制。然而,在结肠炎诱发的癌症中,HSF1的保护活性最近被证明可促进癌症。在乙氧基甲烷(AOM)–DSS结肠炎诱发的癌症模型中,长期暴露于DSS会导致HSF1依赖的mTOR激活并增加癌细胞中的谷氨酰胺分解,并促进肿瘤生长。
在这项工作中,作者询问HSF1在结肠炎诱发的癌症中的促癌作用是否包括对TME的非细胞自主作用。作者发现HSF1在炎症的早期在基质成纤维细胞中被激活,其激活导致ECM重塑,从而支持结肠癌的发展。使用AOM-DSS模型,作者分析了不同时间点的ECM,发现ECM的结构和组成都在观察到肿瘤之前就发生了变化。这些炎症诱导的变化是HSF1依赖性的,因此其进展为CAC。在患者中,作者发现CAC中的基质HSF1高度活化,并且在人类CRC中高度依赖HSF1依赖的蛋白质组ECM签名,从而证实了作者的发现与人类疾病的相关性,并突出了基质HSF1在CAC中的关键作用。
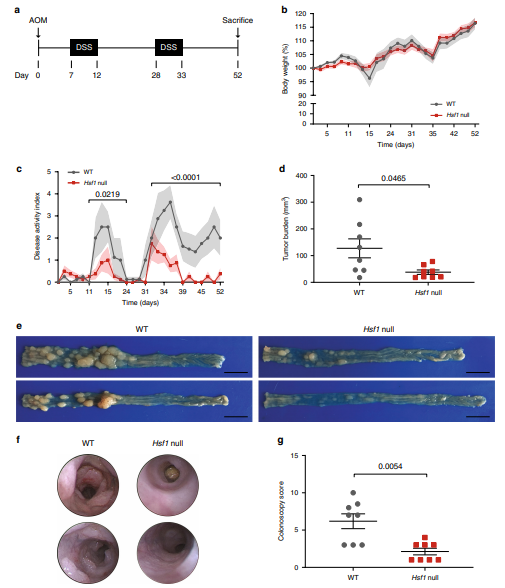
图2:HSF1缺失的小鼠对炎症诱导的癌症具有高度抵抗力
长期暴露于慢性炎症会导致纤维化和癌症。ECM在此过程中起着至关重要的作用,但是,事件的顺序和时机以及将炎症信号与ECM重塑和癌症联系起来的分子线索仍未得到很好的阐明。在这里,作者发现转录主调节因子HSF1在结肠炎症的早期被激活,其激活导致ECM的重塑,从而支持结肠癌的发展。使用CAC的AOM-DSS小鼠模型,作者分析了WT和Hsf1沿CAC起始和进展的不同时间点的ECM结构和组成空小鼠,发现ECM的结构和组成都在早期,恶性前期发生变化。这些炎症诱导的变化被HSF1的丧失显着抑制,其结果是随后发展为CAC。建立作者的实验结果与人类疾病的相关性,作者发现CAC患者样品中基质HSF1的高度活化,以及人类CRC中HSF1依赖性蛋白质组ECM签名的高度保守。
HSF1以前已被链接到CAC,因为它在癌细胞中的激活被证明可以激活mTOR并增加谷氨酰胺分解,从而促进肿瘤生长。在这里,作者揭示了在恶性前炎性阶段,HSF1具有不同的互补作用,从而准备了基质位。作者的体外研究表明,HSF1在成纤维细胞中被激活,而这种活性是胶原纤维沉积所必需的。作者的小鼠和人体研究证实,虽然HSF1在癌细胞中被激活,但它也在基质中被激活,主要在成纤维细胞中,也可能在TME中的其他细胞类型中被激活。未来的工作,包括为成纤维细胞和CAF亚型开发高度特异性的Cre驱动程序,将使作者能够直接评估HSF1在不同基质成分中对炎症和CAC的独立贡献。基质HSF1的时间激活模式与疾病的进程相匹配,空间激活模式与ECM重塑蛋白的时间激活模式相匹配,这表明基质HSF1在炎症驱动的ECM重塑过程中起主导作用。蛋白质组学分析是在包括ECM在内的大肠结肠,上皮细胞,成纤维细胞和免疫细胞上进行的。在这一体积内,ECM蛋白是WT和Hsf1无效处理的结肠之间差异最大的上调蛋白的发现进一步支持了以下结论:基质HSF1在CAC的ECM重塑中起关键作用。
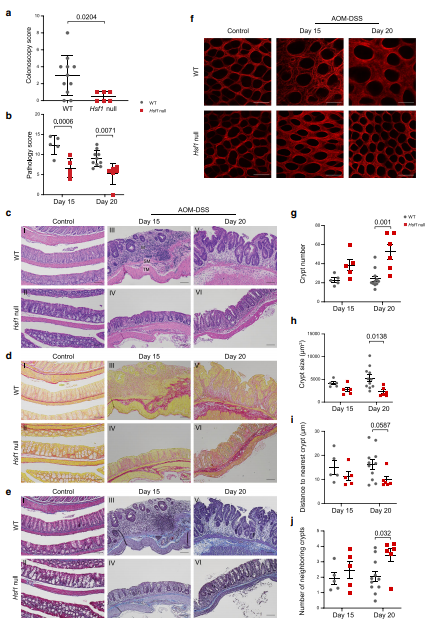
图4:HSF1依赖的ECM重塑先于肿瘤生长
Hsf1无效小鼠在AOM-DSS模型中对癌症高度耐药。它们本身也抵抗炎症吗?Hsf1无效小鼠是否诱发炎症?HSF1被归因于促炎和抗炎活性。例如,它可以在蛋白毒性应激中与TNFα的启动子结合并激活它,但最近也有人建议通过替代的DNA结合位点来抑制TNFα 。类似地,结合至IL-6的启动子,但既可以激活其转录(响应于热休克)或根据不同的结合配偶体抑制它(响应于LPS)。似乎不同的环境(感染,热休克或突变)导致HSF1的促炎或抗炎作用。在AOM-DSS模型中,不同的疾病指标,包括疾病活动性,结肠镜检查和组织病理学评估,以及免疫细胞组成分析,表明Hsf1缺失小鼠比WT受炎症的影响要中等。此外,作者的蛋白质组学分析表明,炎症和伤口愈合是上调程度最高的HSF1依赖性途径之一,这表明在该模型的背景下,HSF1可促进炎症。
HSF1是转录因子。历史上发现由蛋白毒性应激活化,现在公知的是HSF1也在其他上下文和驱动器激活比其它分子伴侣基因的转录。先前作者已经表明,在癌症的背景下,成纤维细胞中的HSF1驱动着涉及炎症,ECM重塑和伤口愈合的基因的转录。在这里,作者扩展了这一分析,以揭示在癌症以及炎症的早期阶段中,基质HSF1激活的蛋白质组学后果。作者建议HSF1被激活以响应炎症,驱动编码基质蛋白(FN1,LAMA1),基质重塑酶(MMP7,MMP9)和基质伴侣(SERPINH1 / HSP47)的基因的转录,从而在非细胞中诱导炎症-自主方式(S100A8 / 9,LCN2),并最终导致癌症。
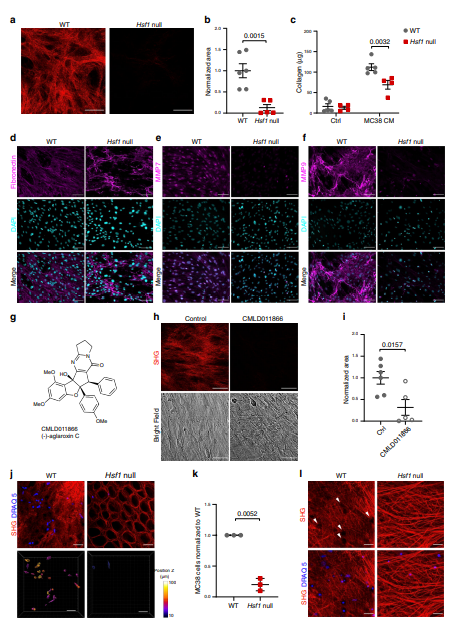
图5:结肠成纤维细胞中HSF1的缺失会损害ECM的分泌。
作者对小鼠结肠在炎症和肿瘤进展的不同时间点的全面分析描绘了ECM结构和成分的动态时间变化,其中大多数是HSF1依赖性的,其中许多是在肿瘤出现之前出现的。基质蛋白表达的这种动态变化也反映在多种基质蛋白的检测中,这些蛋白不是经典结肠基质的一部分,仅在炎症早期或炎症进展为癌症时才在结肠中被激活。钙卫蛋白异源复合物S100A8 / 9就是这种情况。这种复合物,IBD中疾病活动的经典生物标志物特异性地在恶性前期以HSF1依赖性方式被上调,并且在人和小鼠中都没有在正常结肠或恶性期中检测到。
在人类中,CAC开发在IBD患者由于体细胞突变而持续暴露于炎症,这是非常不同的,无论是在遗传改变的频谱,并在疾病的病因学,从零星结肠癌。这些差异是由旨在剖析CAC的突变景观几个最近的研究表明,但作者仍然缺乏蛋白质组数据来匹配这些研究和CAC和CRC之间表达揭开差异。在AOM-DSS模型中差异表达的绝大多数基质蛋白在人类结肠基质中是保守的。并且许多蛋白质在散发性CRC中上调。此外,作者发现HSF1在CAC患者的肿瘤浸润基质中激活,而不在正常结肠成纤维细胞中激活。很难估计炎症本身对作者观察到的蛋白质组变化的相对贡献。最近在结肠炎的小鼠模型中进行了蛋白质组学分析,并在IBD患者中得到证实,突出了甚至在炎症症状出现之前ECM的蛋白质组学变化。在这些小鼠或患者中未监测CAC。作者在CAC模型中观察到的变化是否与炎症,癌症或两者相关,这些变化的哪一部分是特定于CAC而不是散发性CRC尚待确定,这将是未来研究的主题。然而,作者的发现强调了HSF1是结肠对炎症反应的关键介体,因此,它是IBD和CAC中有吸引力的潜在治疗靶标。



