Nature子刊:肾脏脂质代谢/脂滴沉积对慢性肾病影响
时间 : 2023-08-25
糖尿病和高血压是慢性肾病(CKD)最常见的诱因,肾小管间质纤维化则被认为是与CKD进展和肾衰竭相关的主要病理表现。与先前相比,目前对于CKD的发病及机制研究已有很大进步,并且在过去数十年中对CKD临床药物的研发也迅速增加,但是仍无法减缓临床大部分CKD患者进展为肾衰竭。
脂质是细胞膜的重要组成部分,在能量产生、细胞信号转导和细胞稳态中发挥着关键作用。正常肾脏脂质含量相对较低,但在CKD早期会发生脂质聚集,研究发现主要累积在足细胞和肾小管细胞中。而在其他细胞类型,例如内皮细胞、系膜细胞和浸润性单核细胞中,脂质代谢的作用还需进一步的研究阐明。此外,临床数据表明家族性高脂血症患者患CKD的风险更高[1],这表明全身脂质水平异常也可能导致CKD,而甘油三酯(TG)水平升高和高密度脂蛋白胆固醇(HDL-C)水平降低是晚期CKD进程的风险因素。尽管CKD相关的血脂异常已被广泛研究,但肾实质脂质代谢对CKD进展的影响知之甚少。2023年7月,来自美国迈阿密大学的Alessia Fornoni等人,在Nature Reviews Nephrology上发文“Kidney lipid dysmetabolism and lipid droplet accumulation in chronic kidney disease”,文章从临床及实验数据中系统总结了脂滴(LD)在肾实质中积聚的影响,以及胆固醇、脂肪酸、TG和LD积聚导致CKD进展的分子机制,为治疗和预防脂质诱导的肾毒性提供新的治疗思路。

通常情况下葡萄糖是肾脏中首选的能量底物,但当葡萄糖水平较低时,脂质可以作为替代能源。脂质分解过程发生在细胞质,TG分解为游离脂肪酸(FFAs)和甘油,生成的脂肪酸(FA)随后经历β-氧化(也称FAO),生成乙酰辅酶A,而甘油直接进入糖酵解过程。大量FFA经过系列反应生成TG储存在细胞中,这样可以避免FFA累积的破坏作用。然而肾脏足细胞和小管细胞易受脂质积聚的影响,这可能会引起线粒体应激、炎症、肌动蛋白细胞骨架重塑、胰岛素抵抗、内质网应激,并最终导致细胞死亡。
肾脏是一个富含线粒体的器官,对能量的需求很高。在生理条件下,肾脏不同区域的底物偏好性反映了这些区域对ATP的需求:肾小球倾向于使用葡萄糖,而肾小管倾向于使用FAs。FAO是高代谢细胞(如肾小管细胞)的首选能源,FFA分解会产生大量ATP,而肾小球中的足细胞、内皮细胞和系膜细胞主要依赖糖酵解,并在代谢条件改变(如低血糖)时才将FAO作为替代能源。FA进入细胞内供能主要通过FA蛋白转运蛋白1(FATP1)、FATP2或FATP4。此外,CD36作为另外一种长链FA转运蛋白,在近端和远端上皮细胞、足细胞和系膜细胞中高度表达(图1)。CD36也可作为循环可溶性分子(sCD36)存在,健康个体中sCD36来源于内皮细胞,而2型糖尿病患者中其来自于红细胞,并且在DKD中sCD36水平还与胰岛素抵抗相关。
CKD足细胞中脂质摄取和FAO的变化
CD36是足细胞摄取FA的一个非常重要的受体, 肾小球和肾小管CD36高表达与CKD损伤程度相关,这一过程涉及足细胞中的脂毒性和LD积累,以及NLRP3激活进而诱导足细胞凋亡。足细胞由于其复杂的结构和功能而具有较高的能量需求。足细胞中的FAO受几种关键酶和信号通路的调节,包括PPARα和AMPK。PPARα的表达减少会促进DKD进展,而PPARδ的激活可改善糖尿病相关的肾损伤。在高脂饮食诱导的足细胞损伤模型中,AMPK表达减少和FA过载则会导致脂肪生成增加、FAO减少(图1)。
CKD小管细胞中脂质摄取和FAO的变化
在某些病理条件下,如肾病综合征,近端小管可以从尿液或血管中吸收脂质。然而,这种脂质的双向摄取是否直接影响肾功能仍不清楚。与足细胞类似,CD36高表达也与CKD中肾小管损伤有关,它同样会诱导小管上皮细胞凋亡,并促进近端小管细胞的慢性炎症、纤维化和氧化应激。肾脏FATP2(也称为SLC27A2)主要定位于近端小管上皮细胞,并且在FA转运过程中占主导地位。
在人类肾脏中,FAO基因的表达与纤维化相关,数据显示CKD患者肾脏中PPARα和雌激素相关受体-γ(ESRRA)的表达较低。此外在小鼠模型中,通过改变激活转录因子6α(ATF6α)-PPARα轴,证实了影响肾小管间质纤维化的新机制。具体而言,ATF6α是一种参与未折叠蛋白反应的转录因子,也是FA代谢的上游调节因子,其激活显著抑制PPARα的表达,从而降低了FAO,并导致近端肾小管细胞的脂毒性和随后肾小管间质的纤维化(图1)。
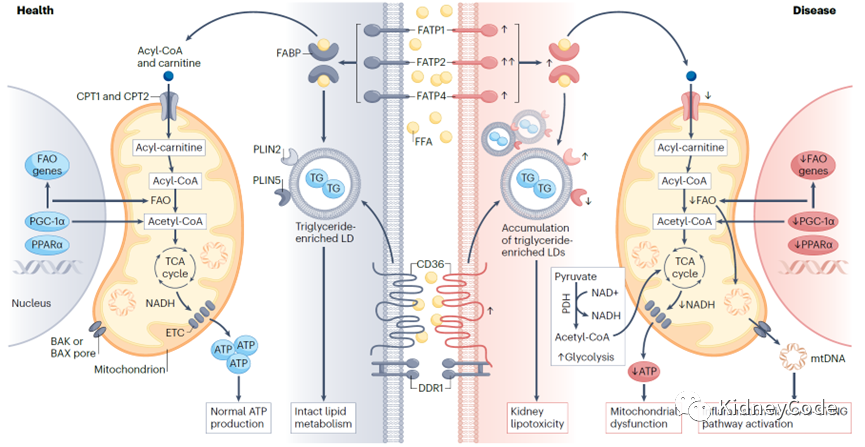
图1 正常及CKD状态下的脂肪酸代谢
细胞胆固醇稳态是肾脏脂质代谢的另一个重要组成部分。临床CKD患者中,经常观察到由于胆固醇反向转运受损而引起的胆固醇积聚,包括DKD、肾病综合征以及与Alport综合征和尿毒症相关等肾病[2]。早期研究表明,FXR是肾脏胆固醇稳态的关键调节因子,其激动剂的使用可以减少SREBP-1c、SCD1、ACC(脂质合成过程中限速酶)的合成,促进脂代谢相关的PPARα、CPT1a、PGC-1α、UCP-2和脂蛋白脂酶(LPL)的增加,从而发挥肾脏保护作用(图2)。
CKD足细胞胆固醇代谢的变化
胆固醇代谢失调是CKD足细胞损伤的标志之一。早期CKD患者肾活检样本显示足细胞胆固醇和LD积累,这可能与ABCA1(调节胆固醇流出)表达降低有关。在其他肾小球疾病中,数据显示肾小球TNF表达的异常还会抑制SOAT1的胆固醇酯化作用,导致胆固醇依赖性足细胞凋亡。
CKD小管细胞胆固醇代谢的变化
肾纤维化伴有肾小管细胞胆固醇代谢的改变,类似于在足细胞中观察到的变化。研究数据显示FXR可以减弱肾纤维化,调节DKD中的葡萄糖代谢、脂肪生成和线粒体生物代谢等过程,并减少肾系膜细胞中的TGFβ-SMAD信号传导和炎症反应。此外,肾小管中胆固醇代谢失调会导致胆固醇晶体的形成,从而导致肾脏炎症和损伤。肾病综合征患者肾小管中的胆固醇结晶沉积与血清胆固醇水平密切相关,但与蛋白尿或肾小球肾炎类型无关。这些数据表明,与其他肾脏分区相比,脂质积聚似乎对肾小球和肾脏近端小管的影响更大。然而,过量脂质的定位在不同动物模型中各不相同,这些模型在多大程度上准确反映了人脂质相关的肾病仍然存在争议(图2)。
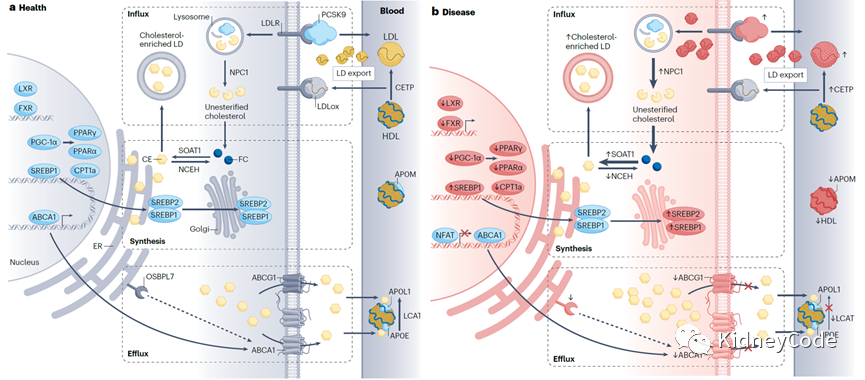
图2 正常及CKD状态下的胆固醇代谢
LD(脂滴)是一种保守的脂质储存细胞器,在多种生物的大多数细胞中调节脂质和能量稳态。脂肪细胞中,LD的形成是一个生理过程,而在其他细胞类型中,包括足细胞和肾小管细胞,LD的产生表明细胞稳态受损,并可能提示这是细胞对脂毒性的保护机制。此外,LD还与其他几种细胞器建立联系,如内质网、过氧化物酶体、线粒体和溶酶体等,这些细胞器对LD的正常生命周期及功能至关重要。多项研究表明,肾脏脂质沉积是临床和实验性CKD中观察到的一种现象(也是其标志)。在肾纤维化患者中,由于循环脂质水平高,LD主要在肾小管和间质细胞中积累,进而影响细胞正常功能及脂质代谢(图3)。
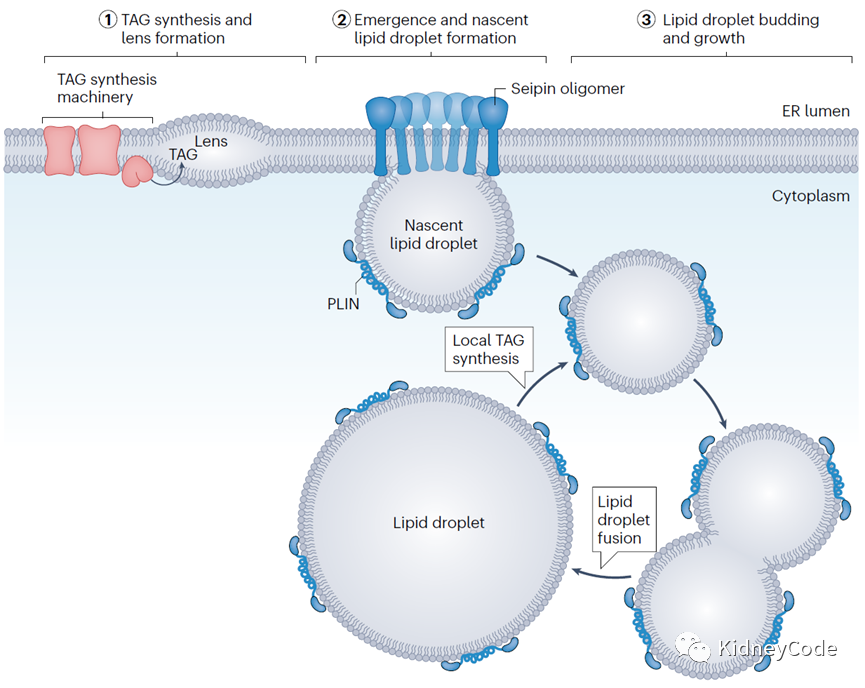
图3 脂滴结构及其生成、降解过程



