Cell Res:解密人类造血干细胞起源
时间 : 2019-09-11造血干细胞(hematopoietic stem cell,HSC)能够在体内产生所有类型的血液细胞,并且通过自我更新和多系分化维持个体整个生命周期的血液系统功能。虽然HSC的发生过程在斑马鱼和小鼠等动物模型已经被充分揭示,但受限于研究技术的缺乏和研究材料的稀缺,目前对人类早期胚胎造血发育的认识仍十分有限。研究人员通过异种移植的功能分析,确认了人类的HSC于胚胎卡内基阶段(Carnegie stage,CS)14(妊娠后32天)最早出现在主动脉-性腺-中肾(aorta–gonad–mesonephros,AGM)区域。与胎肝和脐带血中HSC类似,AGM区的HSC也具有CD45+CD34+表型。
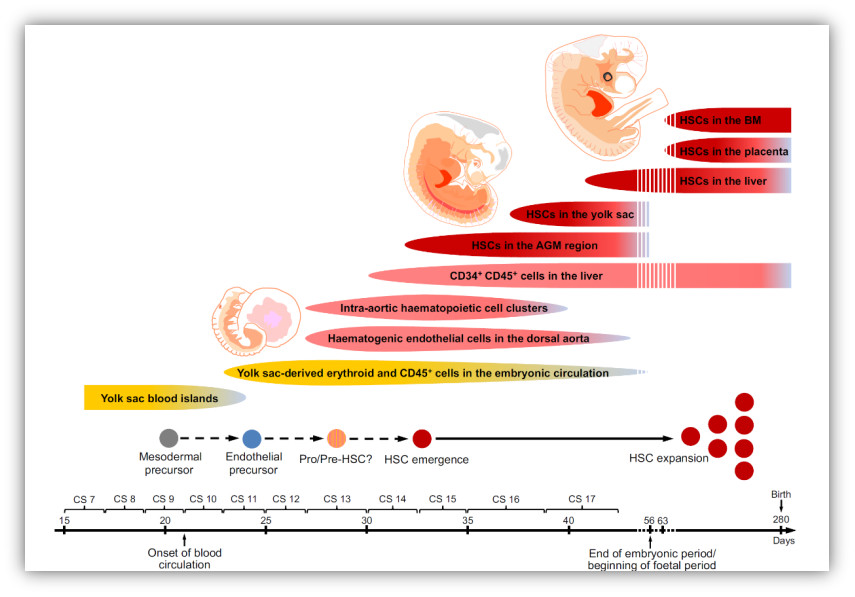
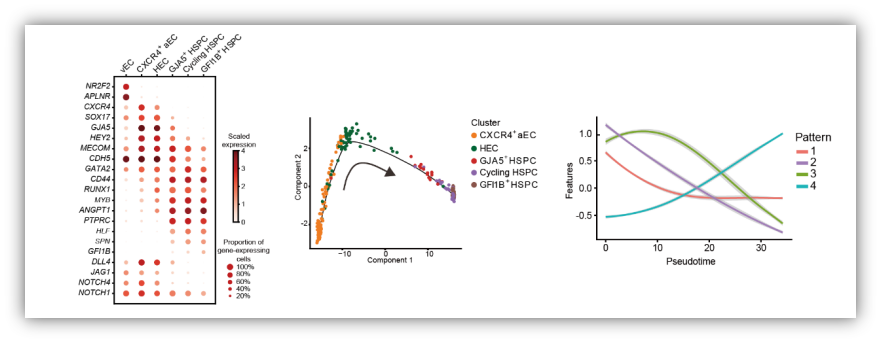
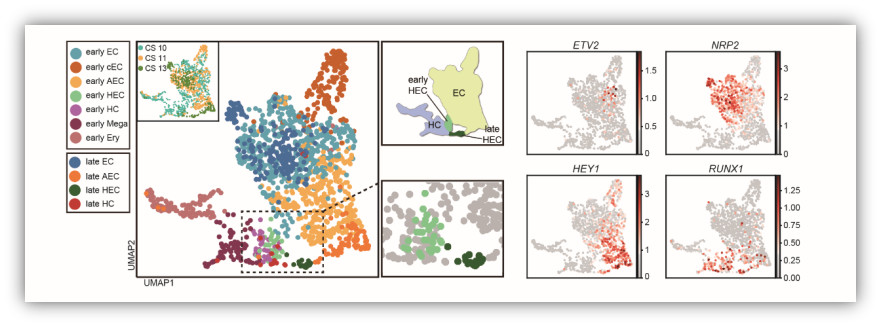
功能学和组织学实验证实,人类胚胎的第一个HSC产生于背主动脉腹侧壁。鉴于人类HSC与血管内皮细胞存在着紧密的时空联系,并且共享一些表面标志,因此推测人类HSC与小鼠类似,均起源于生血内皮细胞(hemogenic endothelial cell,HEC)。目前研究认为,HEC表达内皮基因和生血特异的转录因子RUNX1,但不表达典型造血表面标志如CD43和CD45。HEC的特化是血管内皮细胞选择HSC命运的关键步骤,然而,由于HEC数量稀少、发育过程转瞬即逝,对于内皮造血转化的认识,尤其是对HEC的精准识别,成为造血发育研究领域的重点和难点。
鉴于临床的巨大需求和血液细胞来源有限性之间的矛盾,血液系统尤其是HSC的再生研究显得尤为重要。研究者一直致力于利用多能干细胞高效诱导功能性HSC,但罕见成功的报道,表明对于HSC胚胎发生的时序特征及调控机制的认识仍有待深入,HSC的再生研究依然任重道远。
2019年9月9日,解放军总医院第五医学中心刘兵研究组与暨南大学基础医学院兰雨研究组合作在Cell Research杂志在线发表了题为Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing的研究论文。该研究在国际上首次从单细胞尺度阐述人胚第一个HSC发生全程的细胞层级、分子特征、细胞间相互作用,尤其依靠单细胞转录组数据筛选获得高特异性的HEC标志,精确解析了HEC靶向HSC命运转化的多个阶段,为未来HSC再生提供重要的理论支持和策略指导。