高脂饮食通过调节肠道菌群促进结直肠癌发生
时间 : 2022-12-02是2022年发表在Gastroenterology上的“High-FatDiet Promotes Colorectal Tumorigenesis Through Modulating Gut Microbiota and Metabolites”(IF=33.9),该文揭示了高脂饮食(HFD)通过调节肠道菌群和代谢产物来促进结直肠癌形成的过程。

与其他肿瘤不同,结直肠癌(CRC)在肿瘤发展过程中直接与数万亿肠道微生物相互作用。肠道菌群的组成受多种因素的影响,包括饮食,药物和遗传改变等,而微生物特征的改变会引起肠道菌群失调和CRC。尤其是肠道菌群在结直肠肿瘤形成的早期阶段就会受到干扰,并在肿瘤进展过程中恶化。此外,微生物衍生的代谢产物,例如胆汁酸和短链脂肪酸,也可能促进或抑制CRC的发展。据报道,高脂饮食和肠道微生物群失衡都与CRC相关,但是其中的复杂关系并不清楚。
1.HFD促进AOM和APCmin/+小鼠模型中依赖肠道微生物群的CRC发展
为了研究HFD在结直肠肿瘤发生中的作用,研究者对常规AOM处理的雄性C57BL/6小鼠进行投喂高脂饮食(HFD)、对照饮食(CD)以及HFD联合抗生素处理(HFD+Abx)(图1A)。一段时间后对小鼠进行结肠镜检查,在HFD喂养的小鼠中存在肉眼可见的肿瘤,但在CD喂养或抗生素治疗的HFD喂养的小鼠中未观察到明显的肿瘤(图1B)。而抗生素对肠道菌群的耗竭对HFD喂养小鼠的体重和肥胖体重没有明显影响(图1C)。HFD喂养的小鼠的结直肠肿瘤数量和体积也明显大于CD喂养的小鼠(图1D)。结肠切片的组织学检查(图1E)证实HFD喂养的小鼠与CD喂养的小鼠相比,小鼠发生腺癌、高级别和低级别不典型增生的比例增加,而HDF+Abx组小鼠的腺癌,高度不典型增生和低度不典型增生的比例降低(图1E)。此外,HFD喂养的小鼠的结肠切片显示出更多的Ki-67阳性细胞,表明HFD喂养的小鼠中的细胞增殖增加(图1F),而在HDF+Abx组小鼠中,Ki-67阳性细胞有所减少。
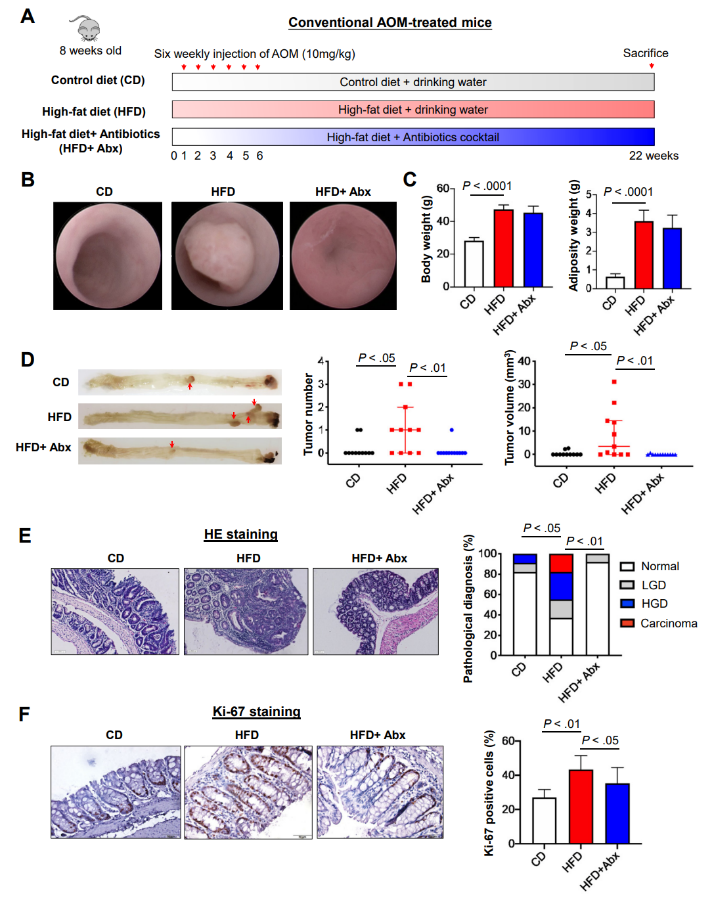
图 1
为了验证这些发现,研究者又建立了转基因APCmin/+小鼠模型(图2A),与AOM诱导的结肠肿瘤小鼠模型的结果一致。HFD显著增加APCmin/+小鼠的体重和肥胖重量,并且HFD+Abx组小鼠的体重和肥胖重量较HFD组相比没有很大变化(图2B)。HFD喂养的APCmin/+小鼠的结直肠肿瘤数目,体积显著高于CD喂养的APCmin/+小鼠(图2C),而抗生素对肠道菌群的耗竭显著降低了HFD喂养的APCmin/+小鼠的肿瘤数量和体积(图2C)。此外,结肠切片的组织学检查证实,与CD喂养的小鼠相比,HFD喂养的小鼠表现出更大比例的腺癌和高度不典型增生(图2D)以及更多的Ki-67阳性细胞,而HFD+Abx组小鼠较单纯HFD组小鼠的Ki-67阳性细胞减少(图2E)。这些一致的发现表明HFD促进结直肠肿瘤的发生,肠道菌群可能在介导HFD相关CRC发展中起重要作用。
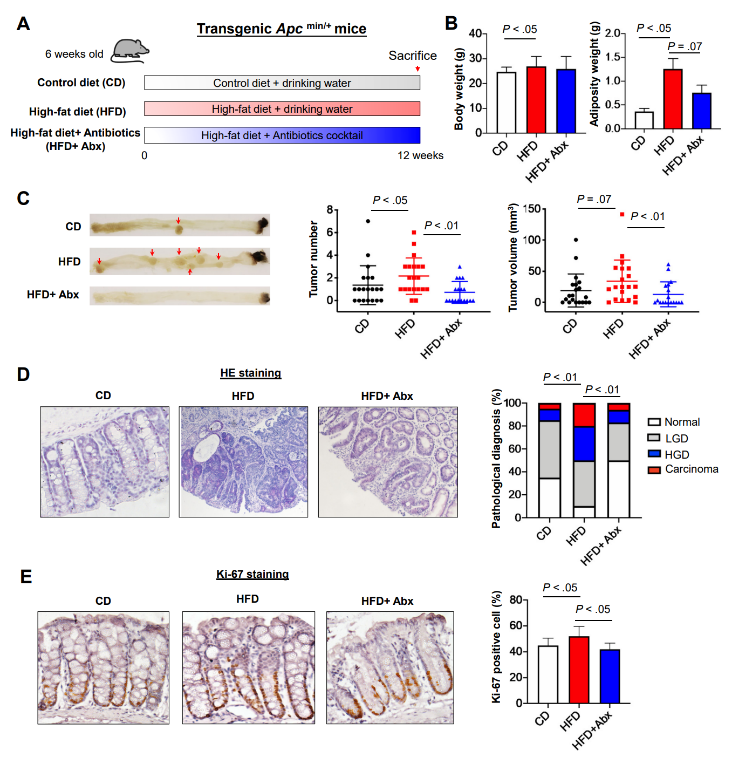
图 2
2.HFD诱导的肠道菌群失调促进CRC的发展
为了探讨肠道微生物失调在HFD相关CRC发展中的潜在作用,研究者在AOM模型中对CD、HFD和抗生素喂养的HFD小鼠的粪便样本进行了鸟枪法宏基因组测序。使用主成分分析(PCA),在三者中中观察到微生物群组成的区别。与CD喂养的小鼠相比,HFD喂养的小鼠中的细菌多样性和细菌丰富度较低(图3A)。几种细菌类群在三组小鼠中存在差异(图2B)。与CD组小鼠相比,HFD组小鼠中潜在致病菌(Alistipes sp. Marseille-P5997 和Alistipes sp. 5CPEGH6)显著增多,然而保护性菌群(Parabacteroides distasonis和Parabacteroides sp. CT06)显著减少(图3C)。使用定量聚合酶链反应在APCmin/+中也发现了相同的结果。另外,共培养实验表明在CRC系(Caco-2 和 HCT116)中,P.distasonis抑制细胞生长,而Alistipes sp.促进细胞生长(图3D)。这表明提示HFD诱导的肠道微生物组成的变化至少部分促进CRC的发展。
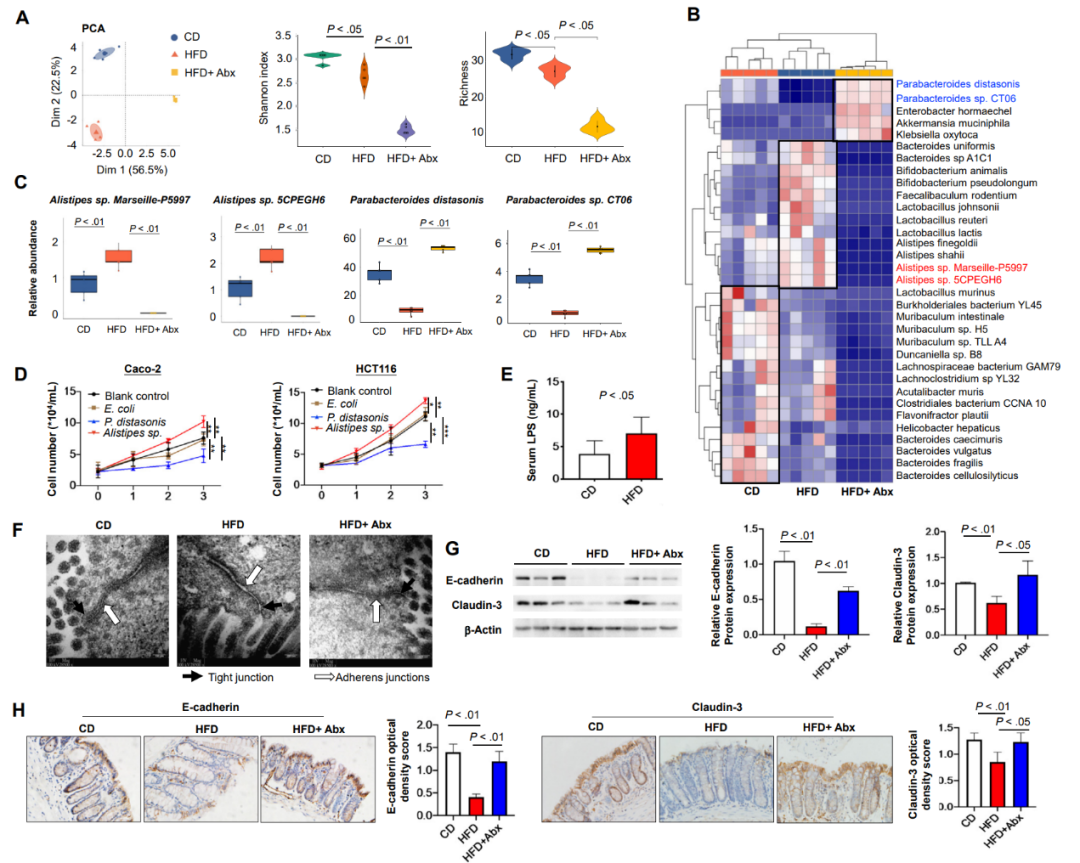
图 3
3.HFD诱导的肠道菌群失调损害肠道屏障功能
为了探讨肠屏障功能在HFD相关结直肠肿瘤发生中的作用,研究者通过测定血清脂多糖(LPS)水平,探讨HFD对小鼠结肠细胞旁通透性的影响。在AOM小鼠模型中,与CD组小鼠相比,HFD处理的小鼠血清LPS浓度升高(图3E)。同样地,透射电镜下的肠屏障结构证实了HFD喂养小鼠结肠细胞间连接的异常,包括顶端连接复合体和细胞旁间隙的扩大,表明屏障功能受损(图3F)。此外,紧密连接蛋白E-钙黏蛋白(一种细胞粘附分子)和Claudin-3(紧密连接的关键成分,是肠屏障完整性的标志)的表达在喂饲HFD的小鼠中显著降低(图3G)。E-钙粘蛋白和Claudin-3蛋白主要在CD组小鼠的结肠上皮细胞膜上表达,而在HFD组小鼠的结肠上皮细胞膜上表达不明显(图3H)。另一方面,用抗生素喂养的HFD小鼠的细菌耗竭部分恢复了HFD引起的屏障功能受损,在透射电镜下改善了肠道屏障结构(图3F),恢复了E-钙黏蛋白和Claudin-3蛋白的表达(图3G)及其分布和密度(图3H)。总之,这些结果表明,HFD至少部分通过引起肠道微生物失调而导致结肠屏障功能受损。
4.HFD调节的肠道菌群促进AOM处理的无菌小鼠的结直肠肿瘤发生
为了进一步验证HFD调节的微生物群在结直肠肿瘤发生中的作用,研究者将HFD喂养小鼠的粪便转移给AOM处理过的无菌小鼠(图4A)。粪便微生物群移植(FMT)不会改变AOM处理的无菌小鼠的体重和肥胖体重。与CD组相比,用HFD喂养的小鼠粪便样本灌胃的无菌小鼠显示出明显的Alistipes富集,肿瘤数目和体积增加(图4B)。在HFD-FMT-AOM小鼠中,结肠肿瘤经组织学证实为低度不典型增生,而且结肠肿瘤中Ki-67阳性细胞较对照组明显增多(图4C,D)。此外,与对照小鼠相比,在HFD-FMT-AOM小鼠的结肠组织中,E-钙粘蛋白和Claudin-3的表达降低,此外,E-钙粘蛋白和Claudin-3蛋白在HFD-FMT-AOM小鼠中被分解(图4E,F)。这些结果共同表明,HFD调节的肠道菌群通过损害肠道屏障功能而有助于结直肠肿瘤的发生。
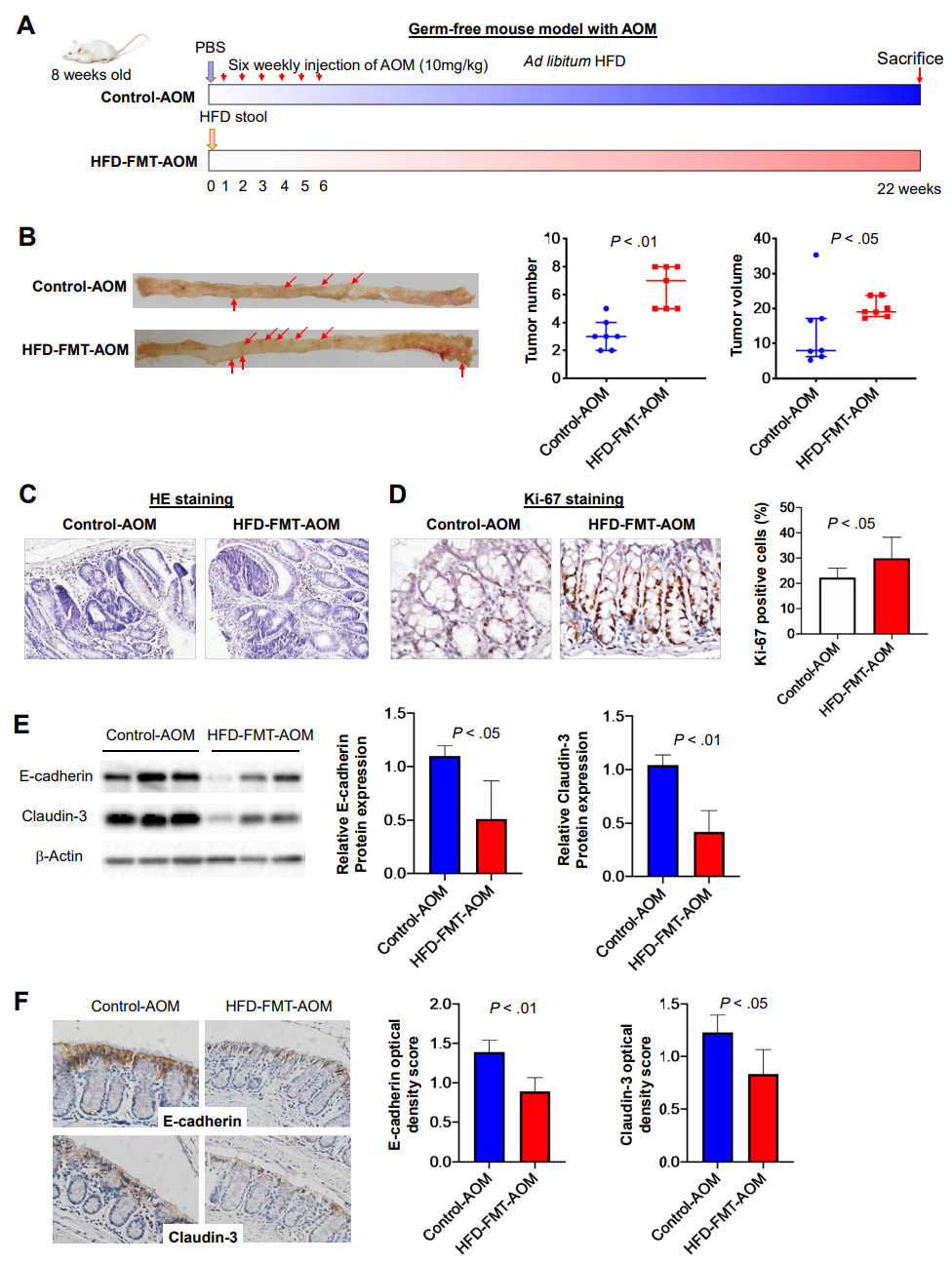
图 4
5.HFD通过改变肠道代谢产物促进结直肠肿瘤的发生
为了揭示HFD诱导的代谢变化,研究者对CD喂养,HFD喂养和抗生素处理的HFD喂养AOM小鼠的粪便样本进行了代谢分析。肠道代谢物随着膳食脂肪摄入量和抗生素治疗而显著差异。与CD喂养的小鼠相比,在HFD喂养的小鼠中鉴定出差异代谢物,其中包括溶血磷脂酰胆碱(LPC)和LPC的下游代谢物LPA在内的甘油磷脂都是HFD喂养小鼠中上调最高的异常代谢物(图5B)。HFD喂养小鼠的上调代谢物富集在不同的代谢组学信号通路中。在这些途径中,甘油磷脂代谢是喂食HFD的小鼠改变的顶级途径(图5C)。另一方面,与HFD组相比,抗生素处理的HFD喂养小鼠恢复了改变的代谢物,LPA和LPC水平降低(图5D)。同样,肠道微生物群的消耗减少了包括甘油磷脂代谢在内的途径(图5E)。进行综合分析以确定HFD喂养小鼠中改变的肠道微生物与代谢物之间的潜在关联。我们发现Alistipes sp. Marseille-P5997、Alistipes sp. 5CPEGH6、Bifidobacterium animalis和Alistipes shahii的富集与LPA和LPC呈正相关。此外,Parabacteroides CT06和Parabacteroides Distasonis的消耗与LPA和LPC呈负相关(图5F)。这些结果表明,改变的肠道微生物群及其相关代谢物都有助于HFD相关的结直肠肿瘤发生。
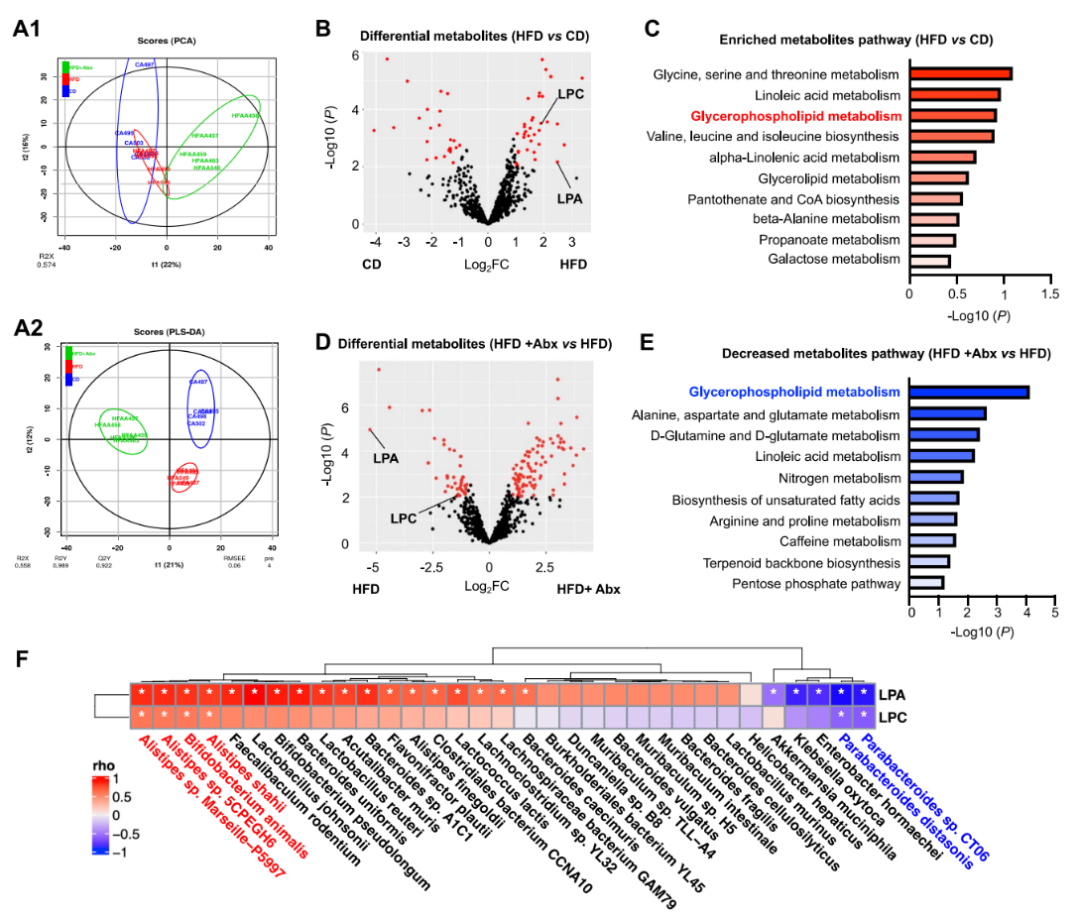
图 5
6.HFD改变的代谢物有助于细胞增殖和细胞连接受损
为探讨HFD改变代谢物在结肠癌发生发展中的潜在作用,对2株结肠癌细胞株(Caco-2和HCT116)和1株正常结肠上皮细胞株(NCM460)进行了差异和非差异代谢物处理。与CD喂养的小鼠相比,HFD喂养的小鼠NDGA和神经酸显著减少。以喂HFD小鼠和喂CD小鼠之间的无差异代谢物之一肌苷作为阴性对照。共培养实验表明,NDGA对结肠癌细胞系Caco-2和HCT116的细胞增殖有明显的抑制作用,但对正常上皮细胞系NCM460的细胞增殖(图6A)和菌落形成(图6B)无明显抑制作用。此外,研究者分别用NDGA和神经酸来处理来源于患者的CRC类器官,发现NDGA和神经酸均能显著抑制CRC类器官的生长。
接下来,研究者专注于富含HFD的代谢物LPA的致癌作用。研究发现LPA显著促进了所有3个结肠细胞系的增殖(图6C)。细胞周期分析表明,与载体对照相比,LPA处理加速了 HCT116 中从 G1期到 S期的细胞周期进程,以及Caco-2 细胞中从G1 到S 和G2期的细胞周期进程(图6D)。一致地,在LPA处理的CRC细胞系中发现增殖细胞核抗原(PCNA),细胞周期蛋白D1(CyclinD1)的表达上调以及P27的表达下调(图6E)。此外,研究者处理了有或没有LPA的患者来源的CRC类器官,以进一步确认LPA的致癌作用,并证明LPA显著促进了CRC类器官的生长和增殖(图6F)。接着研究了LPA是否会影响上皮屏障功能。与载体对照组相比,在LPA处理的HCT116,Caco-2和NCM460细胞中观察到E-钙粘蛋白和occludin蛋白表达显著降低,推断LPA可能会损害屏障功能(图6G)。综上所述,这些结果表明,HFD至少部分通过提高致癌代谢物LPA和消耗潜在的有益代谢物NDGA和神经酸来促进CRC的发展。



