Nature发表四军医大学研究癌细胞铁死亡分子机制
时间 : 2019-07-31细胞死亡对于机体维持正常的发育过程、体内稳态以及阻止如癌症等细胞过度增殖等的疾病非常关键【1,2】。2012年HHMI的Brent R. Stockwell研究组发现了与细胞凋亡(Apoptosis)、细胞坏死(Necrosis)以及其他已知的细胞死亡信号通路有所不同的一个新型细胞死亡信号通路:铁死亡(Ferroptosis)【3】(图1)。该细胞死亡信号通路由RAS选择性致死小分子例如Erastin激活并且依赖于铁离子的存在,能够保护神经细胞暴露在氧化环境中不受损害【3】。由此,细胞死亡信号通路研究方面增加的新的可能性。
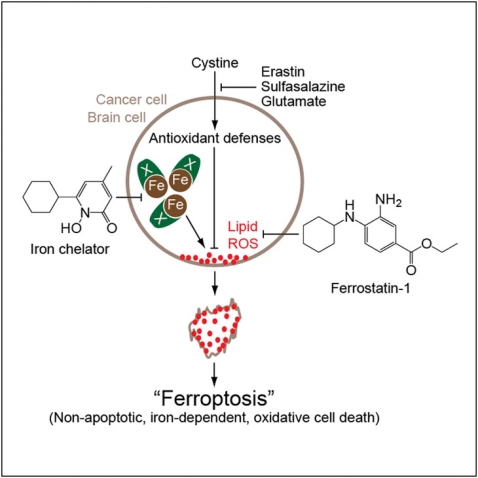
图1 铁死亡信号通路【3】
谷胱甘肽过氧化物酶GPX4是铁死亡信号通路中的核心调控因子,能够通过中和脂质过氧化物保护细胞。抑制GPX4或者是间接消除GPX4底物等方式能够诱发铁死亡【4】。铁死亡对于一些肿瘤抑制因子比如大名鼎鼎的p53的抗癌作用有一定的贡献【5】。间叶细胞癌在通常情况下对于各种治疗方案都有很强的抗性,但是对于铁死亡却非常敏感【6】。抗癌方面的重要作用引起了大家对于揭开铁死亡信号通路详细分子机制的好奇心。
2019年7月25日,来自纪念斯隆-凯特琳癌症中心的姜学军研究组与第四军医大学的陈志南研究组(共同一作为吴佼博士与Alexander M. Minikes博士)在Nature联合发表题为Intercellular interaction dictates cancer cellferroptosis via NF2–YAP signalling的文章,揭示了钙粘蛋白调节的细胞内相互作用从而调控铁死亡信号通路的相关分子机制。

为了揭开铁死亡的具体分子机制,作者设计的实验方案是想要通过改变细胞培养基中的成分或者是细胞培养的数量来操纵细胞代谢的状况。在此过程中,作者们惊讶地发现在细胞密度很高的时候,细胞表现出了对铁死亡的抗性。细胞培养基中去除半胱氨酸后会引发铁死亡,而随着细胞密度的逐渐增加细胞死亡率降低,脂质氧化代谢的比率也逐渐降低(图2)。加入半胱氨酸转运蛋白抑制剂Erastin后在细胞密度比较低的时候大范围造成细胞死亡,同样随着细胞密度的增加细胞死亡率也逐渐降低,进一步确认了此过程中是铁死亡而非细胞凋亡或者是细胞坏死信号通路受到影响。这让作者们将铁死亡的可能调控机制转移到了细胞密度方面。前人已有研究发现,在GPX4敲除的小鼠胚胎成纤维细胞中高密度情况下能够生长,而低密度则会在传代之后迅速死亡,说明细胞密度依赖型的铁死亡信号通路可能真的存在【7】,这给了作者们极大的鼓舞。
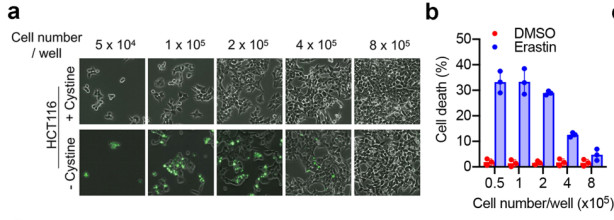
图2 诱导细胞铁死亡后随着细胞密度增加细胞死亡率降低
为了检验细胞密度依赖型的铁死亡现象是否广泛存在,作者们检测了多种人类上皮癌细胞系,发现大多数人类上皮细胞系表现出了细胞密度依赖性。在高密度的情况下,细胞-细胞之间的接触更加紧密。而众所周知E-cadherin (ECAD)是上皮细胞中细胞间相互联系的重要调节因子【8】。在那些细胞密度依赖型铁死亡的细胞系中,随着细胞密度增加,ECAD表达量逐渐升高(图3)。为了进一步证明ECAD在细胞密度依赖型铁死亡的细胞系中抵抗铁死亡的因果关系作用,作者测试了抑制ECAD二聚化、加入抗ECAD抗体、敲除ECAD以及回补实验等方法确认了ECAD在密度依赖型铁死亡过程中的重要作用。

图3 细胞密度依赖性铁死亡的细胞系随着细胞密度增加ECAD表达量逐渐升高
ECAD介导的细胞间相互作用可以向Hippo途径发出信号【9】。Hippo信号途径的主要功能是调节细胞增殖控制以及器官大小,其中涉及到肿瘤抑制因子NF2以及激酶级联途径【10】。在ECAD敲除或者是NF2-RNAi的情况下会使得细胞密度调控的YAP的核定位消失。作者们发现,ECAD与Hippo信号通路的确参与到了细胞依赖型铁死亡的过程中,并且NF2通过抑制YAP的活性从而对铁死亡过程产生抑制。
总的来说,作者们发掘出铁死亡过程中非细胞自主性的调控机制:相邻的细胞通过ECAD-NF2-Hippo-YAP信号通路轴对铁死亡过程做出决定。由于多细胞有机体生存在各种各样的氧化胁迫的环境之中,这种细胞内调控机制可能对于机体免受铁死亡过程提供了关键的保护步骤。由于ECAD-NF2-Hippo-YAP信号通路轴在癌症发生过程中经常发生突变,本研究对于癌症治疗方面可能提供了一个很好的线索,尤其以E-cadherin的下游分子Merlin作为间皮瘤等铁死亡治疗敏感性的标志物提供了新思路和新策略,未来的研究中可能可以通过改变该信号通路轴上的几个因子,从而使癌细胞对铁死亡变得敏感将癌细胞杀死。



