Molecular Cancer:抑制结直肠癌细胞转移的新机制
时间 : 2021-05-14在远处器官形成转移的侵袭性癌细胞是大多数肿瘤相关死亡的原因。细胞-细胞和细胞-基质黏附接触的下调以及尖端-基底极性的丧失是转移的特征。这两个过程都受到支架蛋白Pals1的调控,然而,目前还不清楚Pals1在癌细胞中的表达是否受到影响,以及Pals1是否与该病的发病机制有关。利用肿瘤标本的mRNA表达数据和免疫组织化学染色,作者发现PARS1在结直肠癌中经常下调,与患者的生存不良有关。作者进一步发现Pals1通过抑制Arf6来控制依赖于rac1的细胞迁移,而Arf6独立于Pals1的典型结合伙伴,从而阻止癌细胞的转移。大肠癌细胞PARS1的缺失导致Arf6和rac1活性增强,细胞体外迁移和侵袭增强,小鼠移植瘤转移增加。因此,本文的数据揭示了Pals1作为结直肠癌细胞迁移和转移的关键抑制因子的新功能。值得注意的是,这一新功能与Pals1在紧密连接形成和尖端-基底极性中的已知作用无关。

题目:Pals1 prevents Rac1-dependent colorectal cancer cell metastasis by inhibiting Arf6
译名:Pals1通过抑制Arf6抑制rac1依赖的结直肠癌细胞转移
期刊:Molecular Cancer
IF:15.302
发表时间:2021.5.4
通讯作者单位: 明斯特大学医院
主要内容
为了阐明Pals1在肿瘤发病机制中的作用,作者首先检测了低分化(G3)结直肠癌标本中Pals1的蛋白表达,并与健康对照进行了比较。事实上,作者发现Pals1在大多数被评估的样本中表达降低,而在健康的肠细胞中,Pals1强烈表达,并定位于肠细胞的顶膜,在顶端细胞连接处聚集/tj。E-Cad染色显示,与Pals1相比,高度去分化的肿瘤样本中的E-Cad染色也有类似的减少。值得注意的是,与Pals1高表达的患者相比,Pals1 mRNA的下调与大肠癌患者的生存率下降相关。在该队列中(n=483),仅发现6个错义突变和1个移码突变导致Pals1基因截短,这表明在结直肠癌中Pals1基因表达经常下调,但Pals1基因的体细胞突变/截短相当罕见。进一步研究还发现Pals1基因缺失导致细胞在体外和体内的运动和迁移增强。
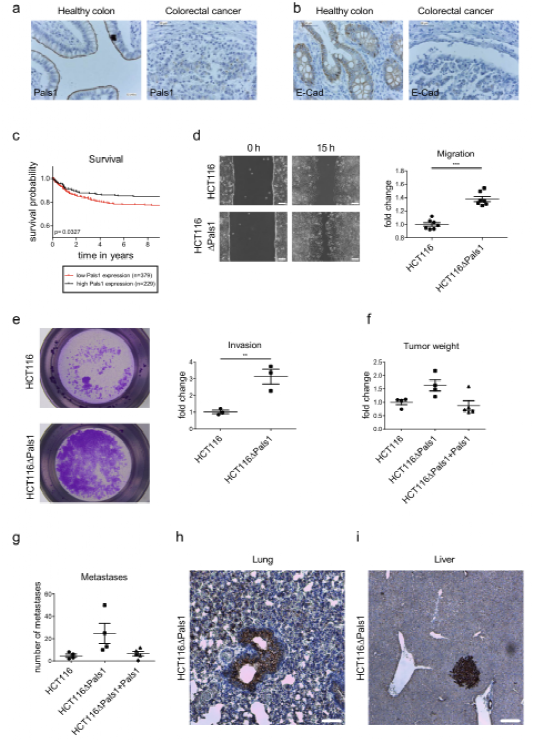
图一:PARS1抑制大肠癌细胞的迁移和转移
细胞的迁移和侵袭是由片状脂膜的形成、回缩和重新形成以及这些细胞突起中的局灶性粘连的翻转所驱动的。片状脂体的动力学受rac1控制的肌动蛋白聚合和分支的调节。在包括结直肠癌在内的几种癌症中,rac1或其激活的GEF表达上调或突变,与患者的不良预后相关。因此,作者测试了Pals1的缺失是否会影响rac1的表达或激活。事实上,p21激活激酶(P21)的纯化的cdc42/rac1相互结合(Crb)结构域选择性地与gtp结合的活性rac1和cdc42结合的下拉实验显示,hct116ΔPals1细胞中rac1的活性增加了四倍,而cdc42的活性没有变化。与这些结果一致的是,在Pals1缺陷细胞中,依赖rac1的PAK的自磷酸化显著增加。最后,EHT1864对Rac1的抑制,通过直接结合阻止Rac1处于失活状态,从而消除了HCT116ΔPals1细胞增加的迁移和侵袭,支持了作者的假设,即pals1缺陷细胞中Rac1的异位激活是这些细胞运动增强的原因。
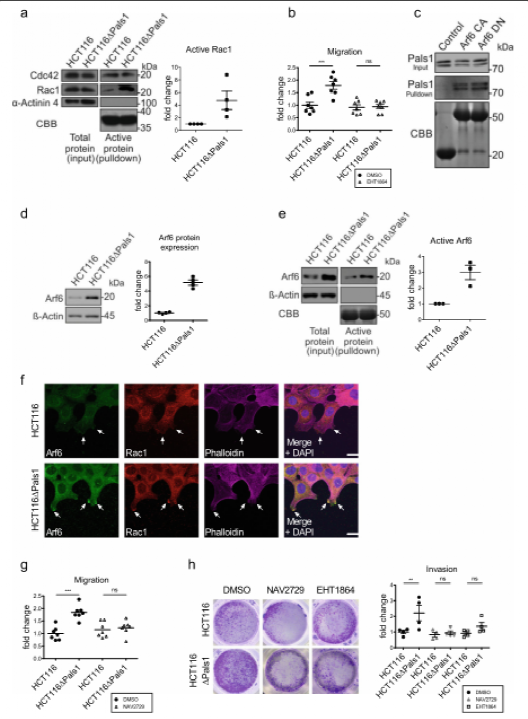
图二:Pals1通过抑制Arf6来控制依赖于rac1的细胞迁移和侵袭
总结
Pals1在体外对Arf6/rac1介导的细胞迁移和侵袭具有抑制作用。因此,PARS1在体内可以抑制大肠癌细胞的转移。值得注意的是,Pals1、CRB和PATJ的规范结合伙伴没有参与这一过程。PARS1的低表达与结直肠癌患者的低存活率相关。作者的研究确定Pals1是结直肠癌进展的新的关键调节因子。



