铁死亡(ferroptosis)是一种铁离子依赖性的程序性细胞死亡形式,其主要机制是当细胞内抗氧化系统遭受损害时,在二价铁或酯氧合酶的催化下,细胞膜系统上含不饱和脂肪酸长链的磷脂分子(PUFA-PLs)发生脂质过氧化(lipid peroxidation),从而导致细胞死亡。
已有研究表明细胞中有多个对抗铁死亡的防御系统,其中最为经典的为谷胱甘肽过氧化物酶4(GPX4)介导的,通过GSH特异性催化脂质过氧化物从而抑制铁死亡发生。
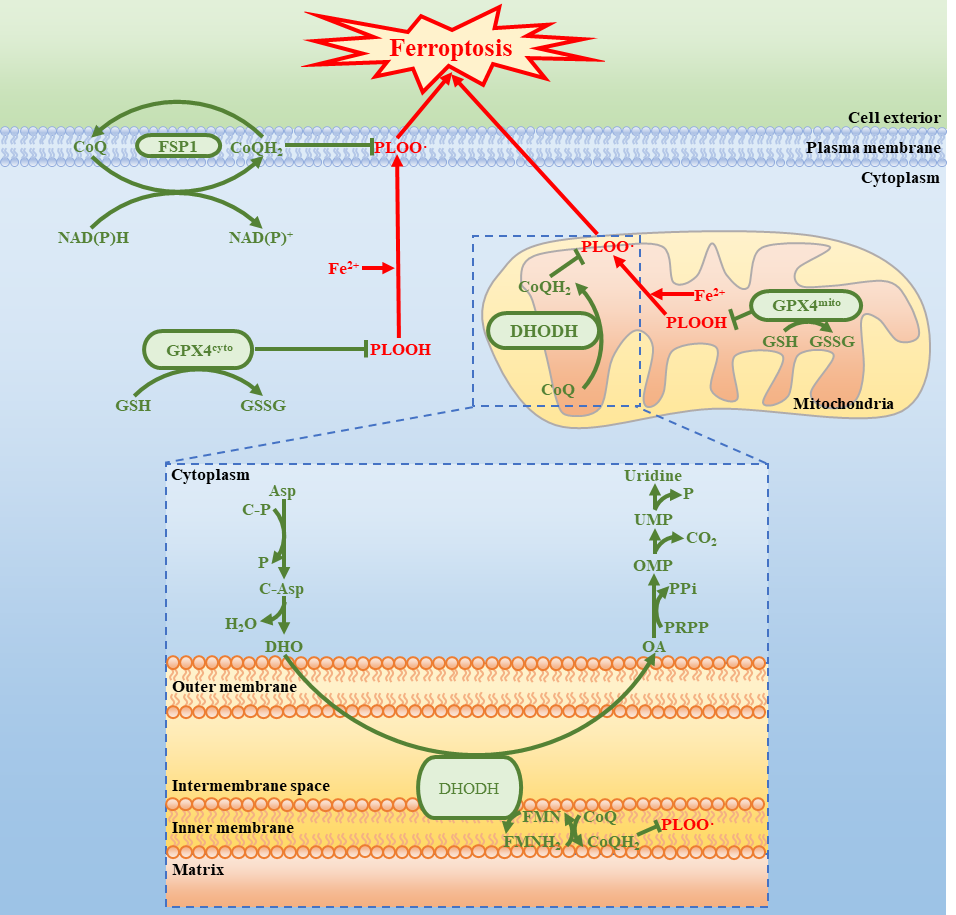
新近发现的铁死亡抑制因子FSP1在细胞膜上将泛醌(CoQ)还原为二氢泛醌(CoQH2),CoQH2作为一种抗氧化剂阻止脂质过氧化抑制铁死亡发生。然而,其它细胞器膜是否存在铁死亡防御系统仍未可知。
2021年5月12日,美国MD安德森癌症中心甘波谊教授团队在 Nature 期刊发表了题为:DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer 的研究论文。
该研究首次发现定位于线粒体中不依赖于谷胱甘肽(glutathione,GSH)的铁死亡防御系统, 并对癌症治疗有重要提示。
线粒体内膜上的二氢乳清酸脱氢酶(DHODH)在阻止铁死亡中起着重要而以前未知的作用。临床前研究结果表明,靶向DHODH可以恢复铁死亡,由于铁死亡在许多肿瘤中活跃,因此,这项研究表明,可以通过诱导铁死亡,抑制肿瘤生长,为癌症治疗提供了新的靶点。
MD安德森癌症中心实验放射肿瘤学系甘波谊教授为论文通讯作者,毛超博士为第一作者。
线粒体是由内膜和外膜两层膜包裹的细胞器,是进行有氧呼吸的主要场所,其内膜上电子传递过程会产生大量活性氧(ROS)。位于线粒体内膜的二氢乳清酸脱氢酶(DHODH)负责催化嘧啶核苷酸合成途径的第四步反应,即二氢乳清酸(DHO)氧化为乳清酸(OA),与此同时内膜中的泛醌(CoQ)接收电子被还原成为二氢泛醌(CoQH2)。
本研究发现,除了合成嘧啶核苷酸,DHODH还可以通过产生线粒体内膜中CoQH2从而在线粒体中抑制铁死亡, 这是因为CoQH2可以作为一种自由基捕获型抗氧化剂(radical trapping antioxidant)来阻止脂质过氧化,从而抑制铁死亡。
首先,研究团队对GPX4抑制剂处理的细胞进行非靶向代谢组学分析发现,嘧啶合成通路可能与铁死亡存在联系。进一步研究发现负责催化嘧啶合成途径的第四步反应的DHODH可能参与抑制铁死亡发生。
更加意思的是,DHODH抑制剂Brequinar(BQR)在低表达GPX4细胞中诱导铁死亡发生,而高表达GPX4细胞中BQR处理明显增加细胞对铁死亡的敏感性。CTRP(Cancer Therapeutics Response Portal)数据库中DHODH表达水平与GPX4抑制剂耐药性呈正相关。而进一步细胞实验也证实同时靶向GPX4与DHODH能够导致铁死亡发生。
机制研究证实DHODH只有定位于线粒体时才能发挥其抑制铁死亡的功能,并且该功能依赖于其酶活性。随后发现在DHODH和线粒体GPX4共同失活会导致线粒体脂质过氧化,且DHODH抑制剂Brequinar(BQR)处理能够显著升高细胞内CoQ/CoQH2比例,说明DHODH通过将CoQ还原成为CoQH2,和线粒体中的GPX4协同抑制线粒体脂质过氧化发生,且与胞浆GPX4以及FSP1组成的细胞膜上铁死亡防御系统是两套不同的体系。
在体内实验中,通过裸鼠成瘤和人源肿瘤异种移植(PDX)模型证实,抑制DHODH可以在低表达GPX4的实体瘤中诱导铁死亡发生和抑制肿瘤生长,而在高表达GPX4实体瘤中铁死亡诱导剂 sulfasalazine 联合BQR具有良好的治疗效果。
总的来说,本研究提出肿瘤细胞中至少存在三种基于不同亚细胞定位的铁死亡防御系统:胞浆和线粒体GPX4,细胞膜上的FSP1,和线粒体内膜上的DHODH;以线粒体来说, DHODH和线粒体定位的GPX4构成了主要铁死亡防御体系。这一重磅发现将为铁死亡应用于抗肿瘤药物开发提供新思路。