高分综述解析: 膀胱癌的生物学和治疗的进展
时间 : 2020-12-12
膀胱癌的研究领域近年来取得了重大进展。二代测序已经确定了膀胱癌中变异最多的基因。这些丰富的信息有助于确定驱动突变,识别可操作的治疗靶点,以及更清楚地了解患者的预后和治疗方向。同样地,我们对膀胱癌细胞方面的了解也有所增加。细胞特征和不同类型的细胞群的识别,以及对肿瘤中正常和异常细胞类型的定量,可以更好地预测治疗反应。非侵入性诊断方法,包括液体活检,也取得了重大进展。这些方法很可能在治疗后评估微小残留疾病和早期诊断方面有相当大的实用价值。免疫检查点抑制剂疗法对膀胱癌患者的治疗效果显著。这些疗法已被证明可以治愈一些膀胱癌患者并显著减少不良事件。这些发展为患者提供了更好的监测机会,特定的治疗选择和延长生存的更大希望。
2020年12月2日,来自美国芝加哥大学Department of Pathology的Thomas F. Gajewski教授课题组在Nat Rev Cancer(IF: 53.03)杂志上发表题为“Advances in bladder cancer biology and therapy”的综述[1]。本文中,将叙述研究膀胱癌生物学中分子和转化方面的最新进展,并讨论它们在该病管理中的当前或潜在的未来临床应用。

主要结果:
膀胱癌的基因改变。
二代测序技术为膀胱癌患者的肿瘤分子分类提供了丰富的分子信息。来自患者的肿瘤组织样本的全转录组mRNA分析使研究人员能够建立膀胱癌的分子分类,同时仍然认识到由于患者的选择在分子亚型分类、方法学差异及病理和临床标准上存在一些差异。膀胱癌被发现是突变率最高的人类癌症之一,仅次于肺癌和皮肤癌。这些突变中最主要的是编码端粒酶逆转录酶(TERT)的基因启动子的突变,其发生频率在膀胱癌患者中为70%-80%。对频繁突变的识别,反过来促进了新的治疗方法,以及对早期发现和治疗后疾病监测的尿液和血液监测。
表观遗传修饰。
膀胱癌也表现出显著的表观遗传失调,如DNA甲基化的变化。对来自患者的MIBC样本的癌症基因组图谱(TCGA)分析发现了DNA低甲基化和高甲基化的聚类。DNA低甲基化在MIBC和NMIBC阶段比MIBC更高阶段更常见,而DNA高甲基化与肿瘤抑制基因的沉默有关(例如,TP53、RB1、CDKN2A和CDH1),并与侵袭性疾病有关。因此,根据DNA甲基化特征对MIBC进行分类可能有助于识别预测性生物标志物,也有助于治疗。肿瘤基因组分析方面的进展还透露,膀胱癌具有更高的比大多数其他癌症突变负荷,特别是在染色质重塑基因编码的蛋白质,如组蛋白甲基转移酶KDM6A,组蛋白甲基转移酶(KMT2C和KMT2D),组蛋白乙酰基转移酶(CREBBP和EP300)和EWI/ SNF染色质重塑复合物(ARID1A)。
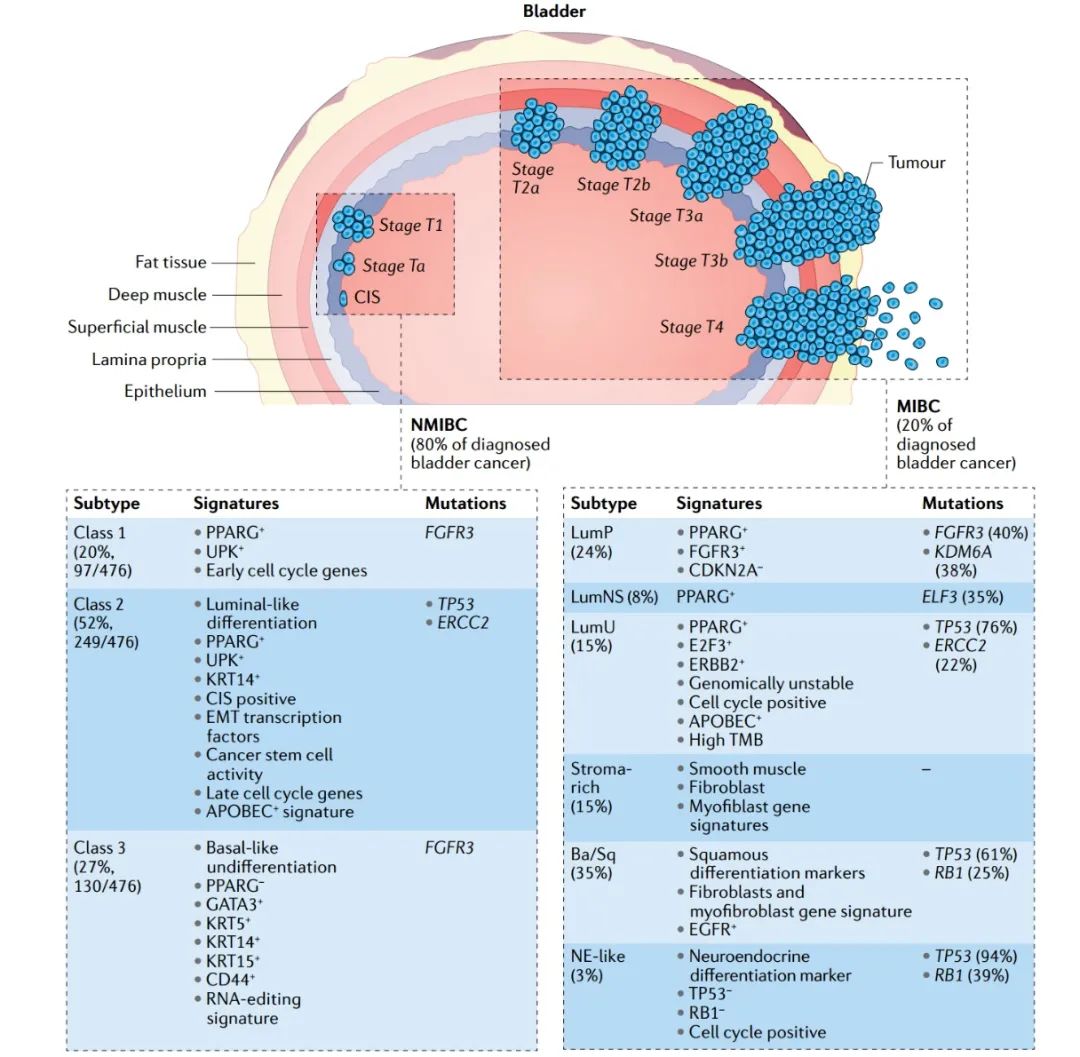
图1:人类膀胱癌的病理和分子特征。
肿瘤微环境。
TME由恶性和非恶性细胞组成,其中癌细胞选择了包括免疫细胞和基质细胞在内的非恶性细胞来帮助它们增殖。越来越明显的是,这些细胞间隔的相互作用影响癌症的进展和对治疗的反应。因此,目前的临床前模型包含了这些分区,并使研究特定细胞类型对癌症进展的影响成为可能。
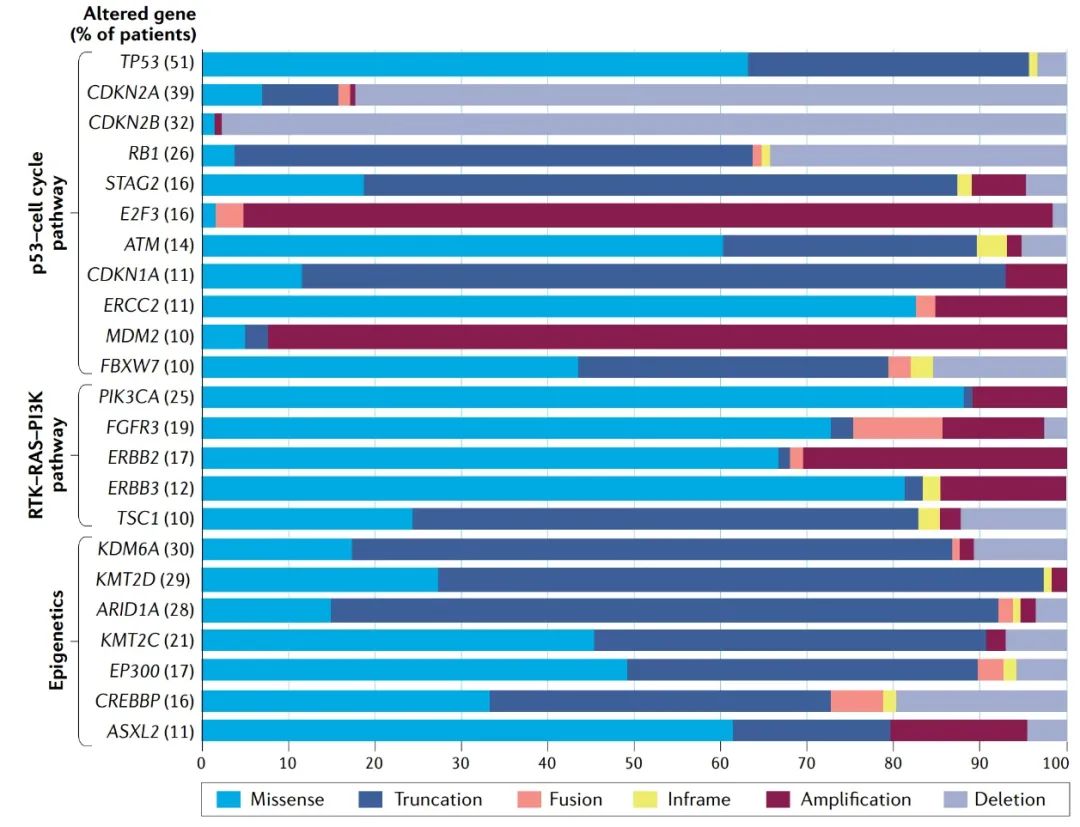
图2:人类膀胱癌的主要基因改变。
分子诊断。
目前膀胱癌诊断的标准是膀胱镜检查和尿液细胞学检查。从病人和医疗系统的角度来看,膀胱镜检查的优点和缺点已经被很好地描述。尿液细胞学检查提供了一个独特的机会来评估洗脱液从一个器官和是非侵入性。然而,它对低级别膀胱癌缺乏足够的敏感性。在膀胱癌的诊断中,近25%的人将被分为侵略性生长的肌层浸润或转移性。因此,发展高度准确、经济有效、无创的膀胱癌诊断和监测测试是临床诊断的一个需要领域,特别是早期和低度的尿路上皮肿瘤。评估患者尿液中的RNA和DNA作为诊断标记已经研究了数十年,但直到最近才得到批准。这样的评估现在不仅包括一个标记,还包括多种评估,如测定基因表达水平、序列变异、组蛋白修饰和DNA甲基化。新一代测序和分离技术的最新进展也揭示了游离DNA (cfDNA)检测和分析的诊断价值。
与尿液中的cfDNA一样,与正常对照组相比,患者血浆中的cfDNA水平也有所提高。虽然大多数cfDNA被认为来自正常的造血细胞分裂,但也有大量的cfDNA来自肿瘤。因此,在包括膀胱癌在内的人类癌症中,人们正在严格研究血浆cfDNA对疾病和疾病复发的早期检测作用。
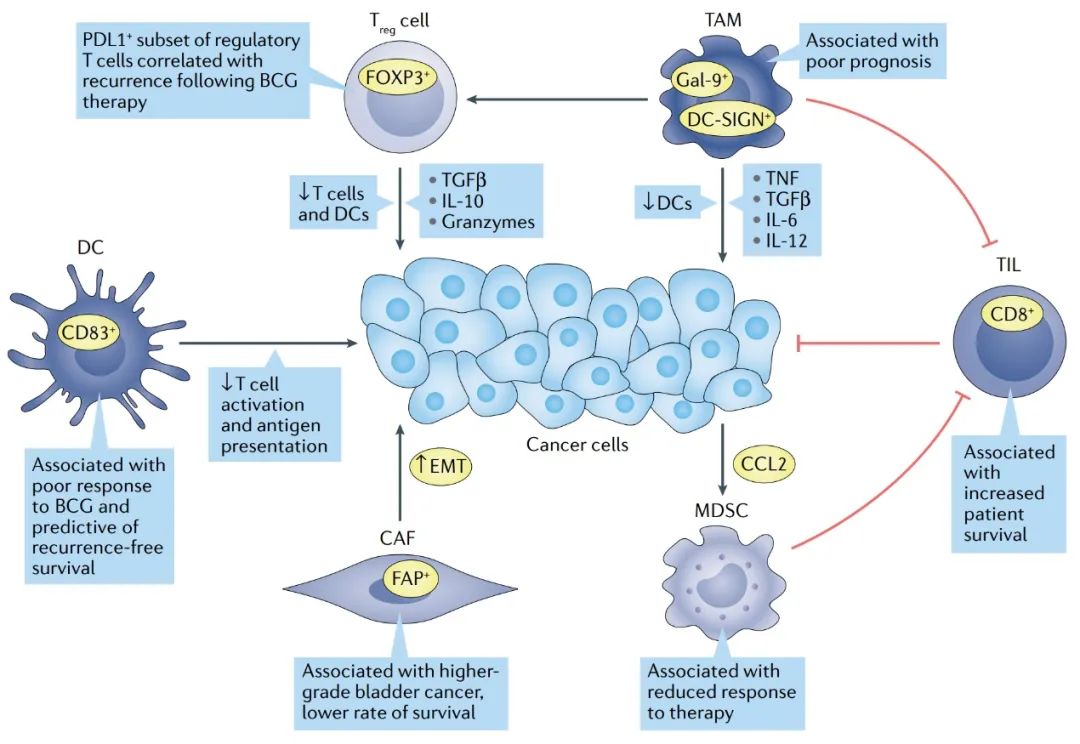
图3:非肿瘤细胞类型与膀胱癌进展有关。
治疗进展。
非肌层侵袭性疾病。
增加膀胱内停留时间和吸收现有的治疗药物。与治疗MIBC相比,治疗NMIBC的一个主要优势在于,非系统性化疗可仅应用于膀胱管腔(膀胱化疗),使身体其他部位的正常组织免受所使用药物的毒性影响。此外,膀胱化疗与经尿道膀胱切除术在减少疾病复发方面是相当有效的。丝裂霉素C、表柔比星、硫替帕、吉西他滨和阿霉素是这一目的最常用的药物,尽管它们有效,但仍有改进的空间。因此,一些临床试验正在进行,以验证治疗药物在膀胱内输送方面的变化。还有一些方法可以增加经膀胱给药后癌细胞对化疗的吸收。这包括在膀胱癌中递送紫杉醇或雷帕霉素的蛋白结合纳米颗粒。临床前研究表明,包裹在聚合物中的紫杉醇的递送降低了膀胱重量,导致紫杉醇在膀胱肿瘤中的浓度高于cremaphor紫杉醇处理的小鼠。
免疫治疗。对于复发风险高的NMIBC患者,目前的治疗标准是在膀胱内给予BCG。该疗法可减少复发和进展,并增加高危患者的生存期,也可作为中度和高危NMIBC患者的维持疗法。然而,由于改变生活方式的根治性膀胱切除术是目前最常见的治疗方法,因此对BCG-难治患者的治疗是该领域最大的挑战。因此,卡介苗联合其他治疗方法正在进行评估,包括卡介苗与IFNα、重组腺病毒IFNα或IFNα、IL-2和联合皮下粒细胞巨噬细胞集落刺激因子(GM-CSF)。最近最令人兴奋的方法是研究ICIs。FDA最近批准了ICI pembrolizumab,一种pd1阻断抗体,用于BCG-难治性NMIBC患者或不能或不愿进行膀胱切除术的患者,46%的有应答的患者出现了持续至少12个月的完全缓解。目前,评估卡介苗在膀胱癌中的II期和III期临床试验有35个,评估ICIs在膀胱癌中的有效临床试验有148个,其中一些使用了多种BCG疗程。
肌层侵袭性和转移性疾病。
分子标记物。MIBC设置的主要目标是预防局部和转移性复发,或如果它们发生成功地治疗此类事件。目前对肌肉侵袭性疾病的治疗标准是新辅助以铂类药物为基础的化疗,然后是根治性膀胱切除术。这一领域的需求之一是寻找化疗敏感性的预测因子。确定对化疗敏感的病人不仅对他们有利,而且可以避免不必要的毒性和对化疗耐药的病人可能致命的根治性膀胱切除术的延迟。在这一过程中,许多基因都在不同程度上与此有关。
免疫检查点抑制剂方案。与其他癌症相比,MIBC具有最高的突变谱,而且具有高突变负担的癌症,如黑色素瘤和非小细胞肺癌对ICIs的反应非常好。Atezolizumab,一种结合PDL1的单克隆抗体,与T细胞上表达的同源受体PD1相反,它被批准用于治疗MIBC患者。来自IMvigor研究的最新发现显示,该制剂在治疗晚期膀胱癌方面持续取得成功。然而,FDA不再认为对所有不符合顺铂条件的患者有利。最近,抗PDL1药物avelumab被批准作为化疗成功的MIBC患者一线维持治疗的突破性治疗指定。Avelumab也被FDA批准用于化疗后MIBC进展的患者。对于MIBC目前还没有正式的维持疗法,但这是ICIs可能会发光的地方。
结论和展望:
几十年来膀胱癌的治疗几乎没有什么进展。上一次取得重大进展是在1977年开始的BCG管理。然而,在过去的7年里,我们看到了前所未有的进步,这主要归功于患者肿瘤分子图谱和检查点阻断免疫疗法。前者已导致尿筛检评估膀胱癌复发的重要临床用途,有几个商业临床试验可用。除了尿液测试,分子谱还可以用于血液样本,这将有助于检测复发。检查点阻断免疫疗法在几乎所有的癌症中都取得了显著的临床进展。最重要的是,ICIs继续取代以前的治疗方案,成为膀胱癌的一线和二线治疗方案,这表明它们的巨大潜力和对其临床应用的更全面的了解。摆在我们面前的挑战包括开发伴生生物标记物,以将患者分配到他们最敏感的疗法,以及与检查点阻断免疫疗法、小分子和其他生物基础疗法更有效的联合疗法。



