Cell子刊:肠道细菌促进肾病患者的心力衰竭
时间 : 2025-09-18慢性肾病(CKD)已成为全球性的健康危机,其患病率不断上升,并对患者的生活质量和死亡率产生深远影响。在 CKD 的诸多严重并发症中,与心血管疾病(CVD)的关联尤为突出,CVD 导致的死亡占 CKD 患者死亡总数的一半以上,心力衰竭(HF)更是其中导致死亡的主要因素。
尽管在理解 CKD 肾功能障碍的病理生理学方面取得了重大进展,但 CKD 患者的心血管并发症发病率的上升凸显了我们知识上的重大空白,尤其是关于肾功能障碍与心脏疾病之间关联机制的认识不足。这些空白突显了迫切需要新的预测性生物标志物和更有效的治疗靶点来减轻这些并发症。
心力衰竭(HF)在慢性肾病(CKD)患者中极为常见,并与肠道微生物群的变化有关,但其潜在机制目前尚不清楚,这给诊断和治疗带来了困难。

近年来,肠道-肾脏轴的概念越来越受到关注,强调了肠道微生物群是慢性肾脏病(CKD)及其心血管并发症病理生理学的关键因素。
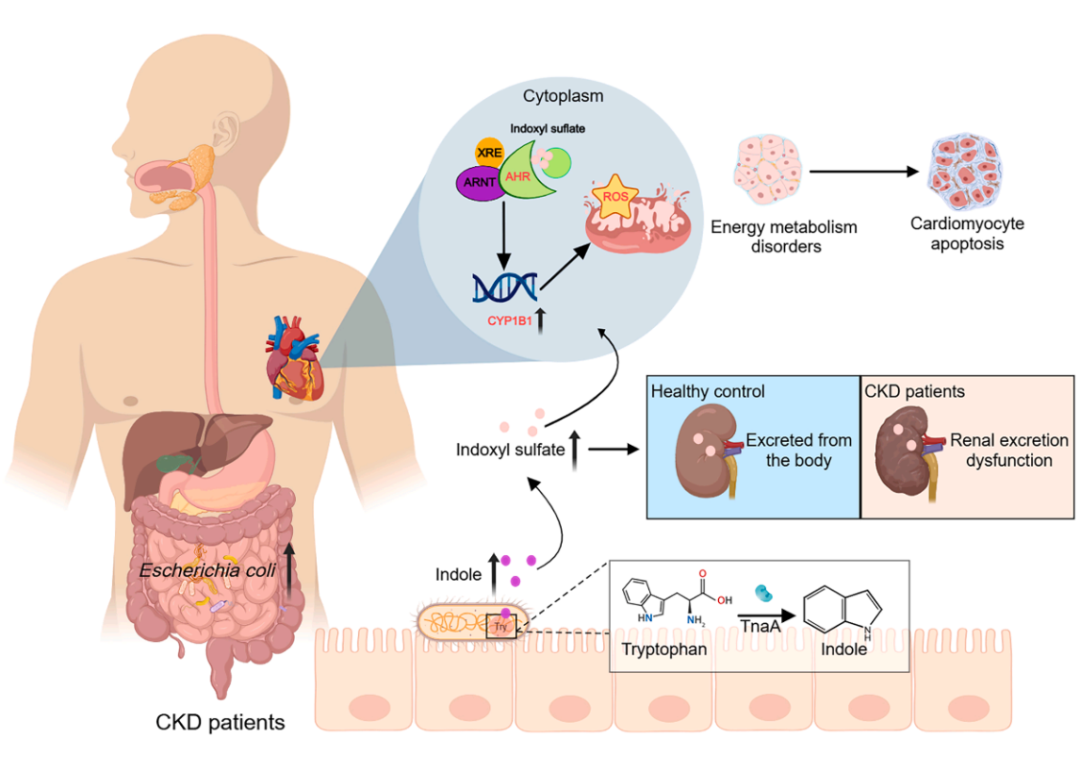
在肾功能正常的情况下,肠道微生物群产生的代谢物能被肾脏有效清除,防止其在血液循环中积聚。然而,在慢性肾脏病的背景下,这种清除能力显著下降,导致尿毒症毒素例如硫酸吲哚酚(IS)、对甲酚硫酸盐(PCS)和三甲胺 N-氧化物(TMAO)的积聚。这些毒素会加剧肾脏功能障碍,并促进全身性炎症,进而加速包括心力衰竭(HF)在内的心血管疾病(CVD)的发展。在此框架内,肠道微生物组不仅成为肾脏功能的关键调控因子,还通过肠道-肾脏-心脏轴影响心血管结局,表明了其可能成为慢性肾脏病相关心血管疾病的潜在诊断和治疗靶点。
血液透析和腹膜透析被用于清除尿毒症毒素。但这些方法存在局限性,尤其是在清除肠道微生物群来源的尿毒症毒素(例如 IS 和 PCS)方面。最近有研究已将硫酸吲哚酚(IS)确定为慢性心力衰竭患者心血管事件的潜在生物标志物。这些发现突显了迫切需要创新的、靶向肠道微生物群的治疗策略来解决这些有害毒素的来源问题。
在这项最新研究中,研究团队确定了由大肠杆菌(E.coli)通过色氨酸酶(TnaA)途径产生的硫酸吲哚酚(IS)是慢性肾病相关心力衰竭的关键代谢物。
从机制上讲,硫酸吲哚酚(IS)会破坏心脏中心肌细胞线粒体的功能,并通过 AHR-CYP1B1 信号轴诱导心肌细胞凋亡,从而推动心力衰竭的发展。为了靶向肠道微生物群-IS 信号轴来改善慢性肾脏病相关心力衰竭的临床状况,研究团队应用益生菌制剂来降低大肠杆菌的数量和 IS 的水平,从而改善了大鼠以及慢性肾病患者的心脏结局。
此外,在一项前瞻性慢性肾病队列研究中,大肠杆菌的数量显示出对 6 个月内心力衰竭发病早期预测的诊断潜力。这些发现强调了肠道微生物群在慢性肾病相关心力衰竭中的关键作用,并表明了靶向肠道微生物群的治疗和诊断策略可用于临床干预。
该研究的核心发现:
-
伴心力衰竭的慢性肾病患者体内大肠杆菌及大肠杆菌产生的硫酸吲哚酚(IS)水平升高;
-
硫酸吲哚酚通过 AHR-CYP1B1 信号轴导致心脏心肌细胞线粒体功能障碍;
-
益生菌 DM02 可降低硫酸吲哚酚水平并改善大鼠和人类慢性肾病患者的心脏功能;
-
肠道微生物群特征可预测慢性肾病患者未来发生心力衰竭的风险。