Nature:痛觉神经元通过CGRP-RAMP1轴促进胃癌进展
时间 : 2025-04-22
2025年2月,美国哥伦比亚大学Timothy C. Wang教授团队在 Nature 上发表了题为 Nociceptive neurons promote gastric tumour progression via a CGRP–RAMP1 axis 的研究,该研究揭示了胃癌与CGRP+痛觉神经元之间存在的一种功能性神经-癌症回路。这一发现首次揭示了颅外实体肿瘤与外周神经系统相互作用的新机制,为针对神经-癌症互作的治疗提供了潜在的策略。
研究背景
肿瘤微环境中的周围神经系统(PNS)在肿瘤发生和进展中发挥重要作用。中枢神经系统(CNS)肿瘤可通过电信号和化学信号与神经元直接建立突触样连接,而颅外实体瘤(如胃癌)与神经系统的相互作用机制尚不明确。此前研究表明,痛觉相关感觉神经元可通过抑制免疫监视或诱导癌细胞自噬间接调控肿瘤生长,但未发现直接的突触样结构。值得注意的是,肿瘤神经支配存在器官特异性,例如切断迷走神经显著抑制胃癌进展,提示感觉神经可能在胃肿瘤发生中具有特殊作用。本研究旨在揭示胃癌细胞与周围感觉神经元间的直接信号通路,并探索靶向该通路的治疗潜力。
胃癌中的神经元扩张
作者利用免疫染色分析了正常小鼠胃组织和四种胃癌小鼠模型中的胃癌组织的神经支配行为。在正常胃组织中,囊泡性乙酰胆碱转运体(VAChT)阳性副交感神经最丰富;在四种胃癌小鼠模型中,CGRP⁺感觉神经在腺体中扩张程度最大,且在胃原位肿瘤中主要由CGRP⁺伤害感受神经支配,皮下肿瘤神经支配具有部位和器官特异性。人胃癌组织微阵列证实,肠型和弥漫型胃癌中CGRP⁺神经密度高于正常胃。
多种胃癌模型中纯化的胃癌上皮细胞神经生长因子基因表达分析表明,Ngf基因上调最显著。急性胃损伤(质子泵抑制剂DMP-777或高剂量MMU化学致癌物可致急性胃损伤)、Kras G12D突变等均可致胃上皮细胞NGF表达上调。原位杂交确认KRAS激活后,胃峡部区域NGF早期显著上调。Ngf基因过表达使胃黏膜CGRP⁺感觉神经扩张,且增加微血管密度。将可以和NGF结合的TRK受体进行抑制,即使用抑制剂恩曲替尼,或将Ngf基因敲除则抑制了感受神经的扩展,表明其依赖NGF-TRK信号传导。
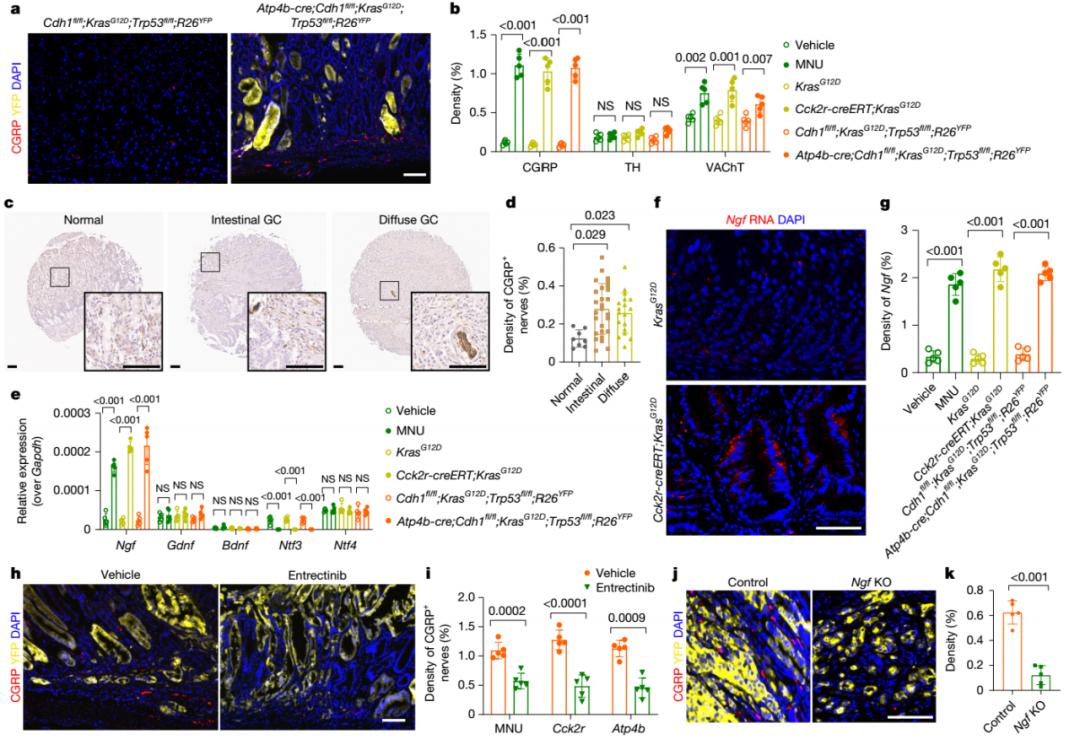
图1.感觉神经通过NGF-TrkA信号通路在胃癌组织中扩张
胃癌优先吸引CGRP+ 神经元
-
逆行追踪:
作者通过逆行追踪法研究了正常胃的神经支配,发现正常胃的神经元主要投射至单侧颈静脉神经节复合体(JNC)和胸段7-13背根神经节(DRG)。说明JNC和DRG是胃部感觉神经元的主要来源。CGRP+ 肽能痛觉神经元和 IB4+ 非肽能痛觉神经元是相互排斥的亚型,CGRP+占DRG中全部标记的胃支配神经元,占JNC约82.25 ± 4.99%左右的标记胃神经元。
-
病毒示踪:
使用去糖蛋白的狂犬病毒来证明胃癌的神经支配。狂犬病毒的神经嗜性可以特异的感染和传播在神经元之间,将糖蛋白基因敲除是为了只感染胃癌细胞而不影响正常细胞,并且将其替换为了荧光标记蛋白(如dsRed),可以可视化追踪和标记与胃癌细胞直接相连的感觉神经元。结果显示,在JNC和DRG中检测到用dsRed标记的神经元,且所有标记的神经元都表达了CGRP,表明胃癌细胞对CGRP+神经的特异性吸引,提示其在肿瘤神经支配中的关键作用。
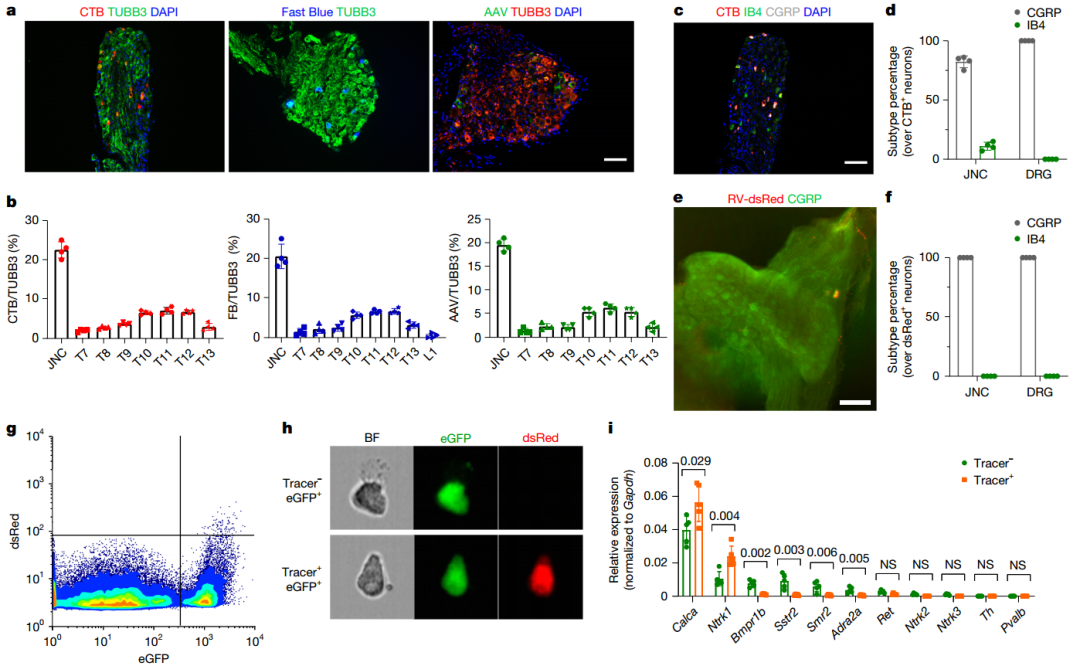
图2. 支配正常胃和GC的感觉神经元的识别
胃癌中CGRP-RAMP1信号轴上调
在胃癌小鼠模型中,作者发现Calca mRNA(编码CGRP)和CGRP肽的水平显著升高,且NGF过表达小鼠中也表现出类似的变化。通过TRK受体拮抗剂恩曲替尼治疗,CGRP的合成和释放减少。进一步分析发现,CGRP受体组成部分CalcrL和Ramp1在正常胃和胃癌细胞中均有表达,且Ramp1在胃癌细胞中表达显著上调。TCGA数据集分析表明,RAMP1高表达与胃癌患者总体生存率差相关,提示RAMP1可能作为胃癌的潜在预后标志物。
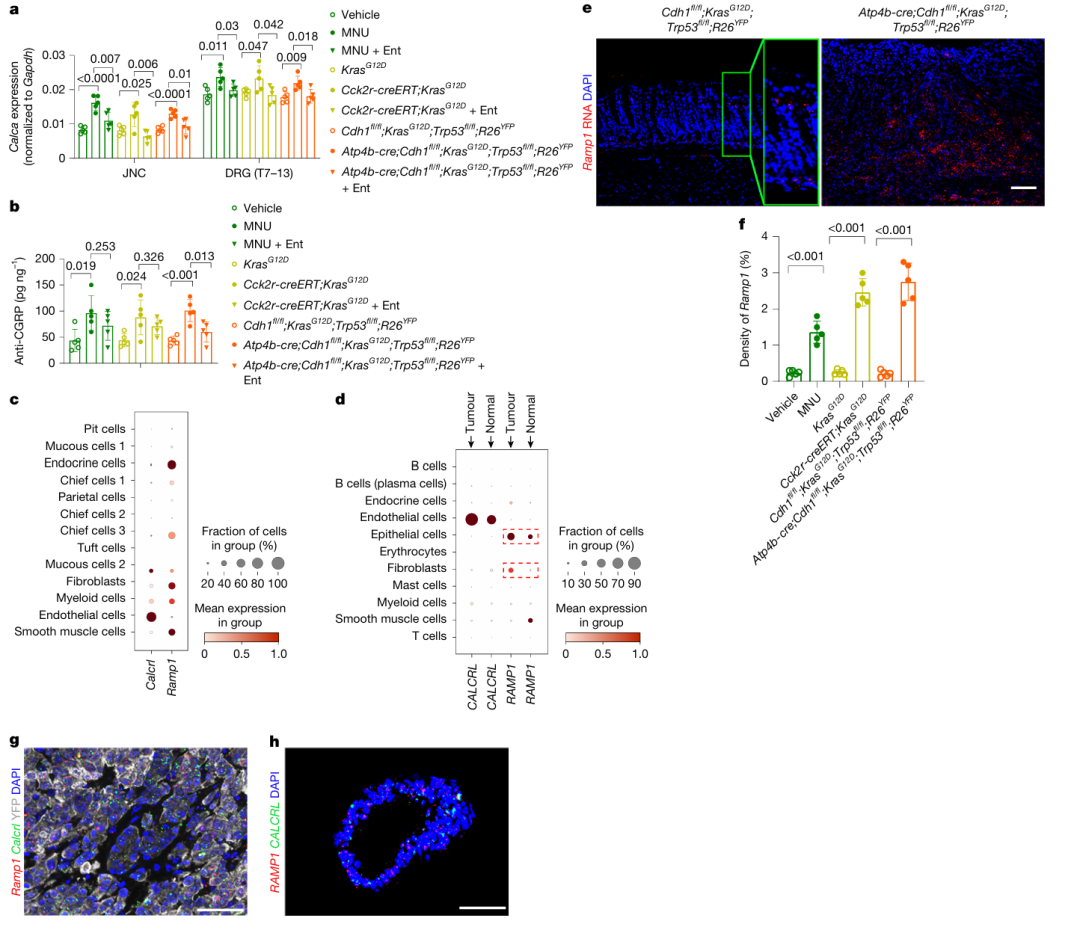
图3. 感觉神经肽CGRP及其受体RAMP1在GC中异常升高
痛觉神经元促进胃癌发展和转移
作者通过化学遗传学激活法研究了痛觉神经对胃癌进展的作用。化学遗传性激活模型是利用化学物质来调控特定基因表达或特定细胞活动的实验方法。其中DREADD激动剂用于诱导痛觉神经元的神经递质释放,该激动剂通过与特定的改造型蕈毒碱型乙酰胆碱受体结合,来实现对神经元活动的精确控制,该受体对内源性乙酰胆碱无反应,但可以被特定的外源性化合物,如氯氮平-N-氧化物(CNO)激活。
实验选用了R26-hM3Dq小鼠与Trpv1-cre小鼠杂交TRPV1+痛觉神经元与CGRP+痛觉神经元在解剖分布、生理功能及病理作用上高度重叠。这对于长期激活实验的意义是,特异性的刺激关注的神经元,避免神经递质长期刺激其他神经元而导致神经长期兴奋带来的伤害。
研究发现激活TRPV1+痛觉神经显著加速了胃癌的生长和溃疡愈合,并促进肿瘤的增殖。抑制CGRP受体通过瑞美吉泮治疗可减少肿瘤发展,表明CGRP对肿瘤发生发展有促进作用。此外,痛觉神经元还能促进胃癌转移,在共培养模型中,激活的痛觉神经元显著促进癌细胞向DRG迁移;在体内模型中,激活伤害感受神经增加了循环肿瘤细胞数量,建立的自发转移模型中,处理后的小鼠肝转移明显增多。
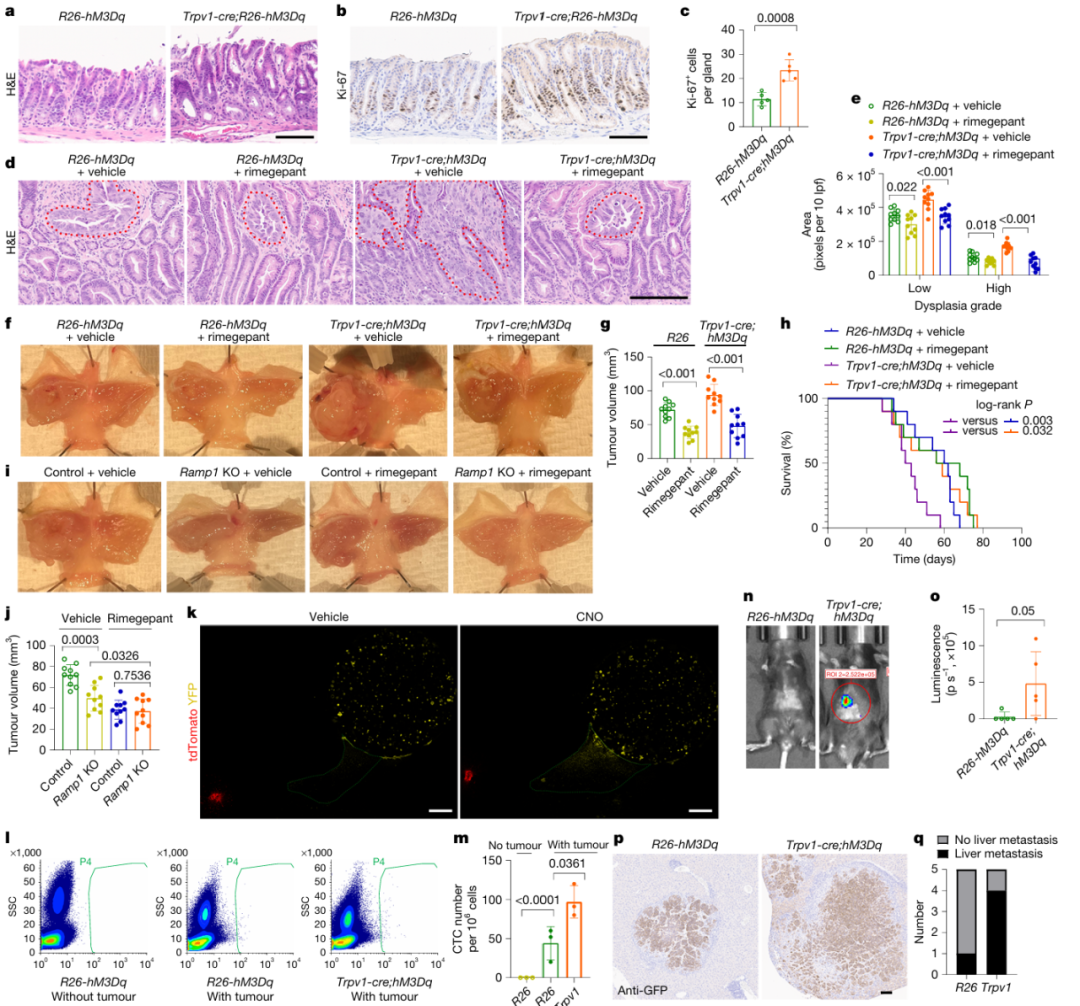
图4. 痛觉神经元通过CGRP信号通路促进GC的发展和转移
胃癌中的功能性神经元回路
在之前的研究中,作者发现胃癌组织中CGRP+ 感觉神经非常丰富,因此通过构建3D共培养模型来研究胃癌细胞与痛觉神经的相互作用,发现CGRP+痛觉神经与胃癌球体建立了紧密的解剖和功能连接。对表现出神经连接的胃癌球体进行分析,发现与神经连接的癌细胞表达了许多化学突触基因,且关键转录因子NEUROD1和ASCL1上调,并观察到两者之间存在类似突触的结构。
化学遗传学激活感觉神经元后,胃癌细胞表现出缓慢的钙离子释放,这一过程可以被CGRP受体拮抗剂瑞美吉泮阻断,该药物原本用于偏头痛的治疗。此外,光遗传学激活胃癌细胞后,痛觉神经元也表现出快速的钙离子流动,并表达更多的CGRP,表明胃癌细胞与感觉神经元之间存在双向的电信号传递,即CGRP+神经通过钙释放调节癌细胞。
为了确定这种神经-肿瘤连接是否相对特异于胃癌细胞,将 DRG 与正常胃类器官共培养。结果发现,痛觉神经元可以向正常胃类器官方向生长,但是不会形成紧密连接,同时也不表达NGF,提示着NGF对于连接至关重要。敲除Ramp1或用肉毒杆菌毒素处理痛觉神经元,虽不影响神经-肿瘤连接形成,但可消除CNO激活伤害感受神经元后胃癌球状体中的钙离子流,并减弱CGRP-RAMP1轴对胃癌球状体生长的影响。
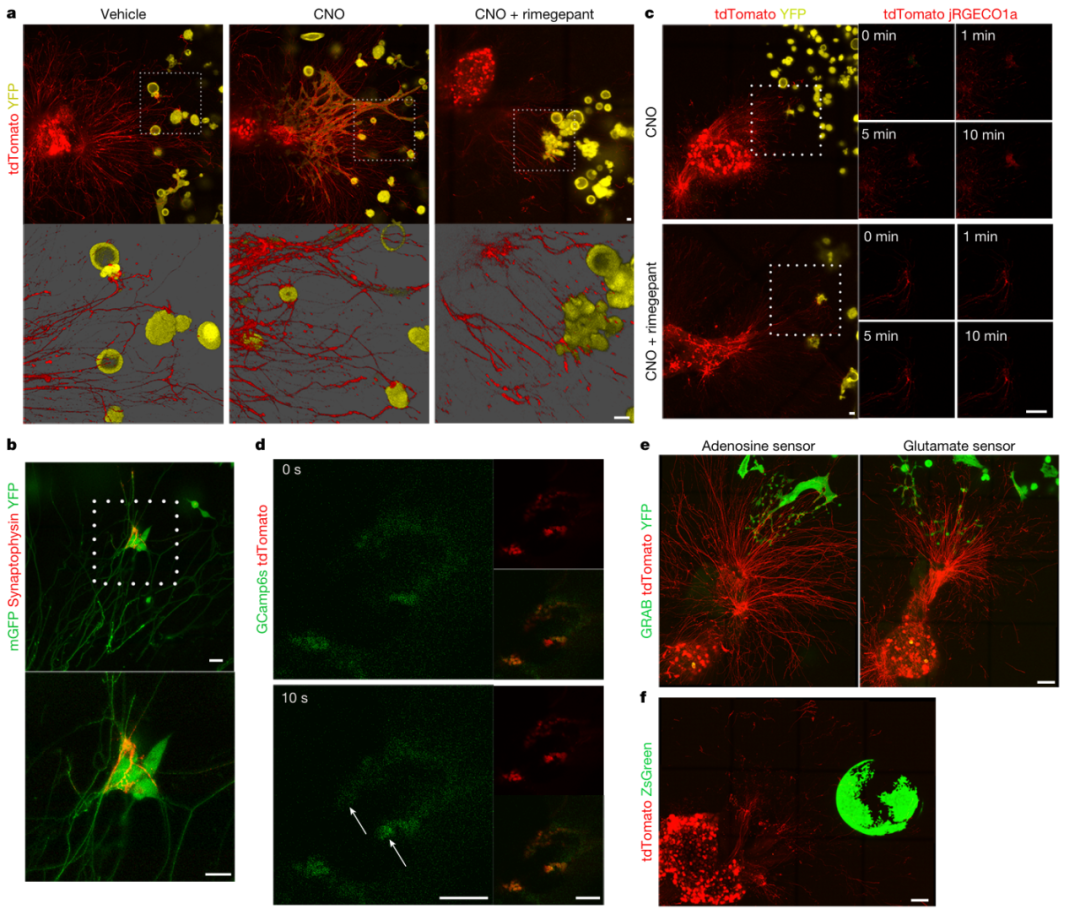
图5. 痛觉神经元直接与胃癌细胞相互作用
总结
作者团队创新性地揭示了胃癌与感觉神经元之间的功能性回路。胃癌通过NGF-TRK通路吸引CGRP+感觉神经元,激活后通过CGRP-RAMP1轴促进胃癌的生长与转移。此外,通过CGRP受体拮抗剂瑞美吉泮的实验验证,抑制CGRP信号轴可有效抑制胃癌进展并延长生存期,提示CGRP信号轴可作为胃癌治疗的新靶点。尽管CGRP-RAMP1轴在多种肿瘤研究中已有涉及,但本研究通过多种方案对其机制进一步研究,验证了其在胃癌中的独特作用,为胃癌治疗提供了新的视角和潜在策略。



