Nature:低氧诱导的癌症炎症性细胞死亡机制
时间 : 2025-01-06癌症组织中通常包含低氧或缺氧区域,这种微环境使癌细胞能够适应并激活多种信号通路,从而提高其抗肿瘤治疗的能力。缺氧条件下,癌细胞会启动低氧诱导因子(HIF)相关基因表达,并通过激活如NF-κB等炎症和先天免疫相关途径,调节细胞存活与死亡的平衡。HIF、AMPK和NF-κB等信号通路的相互作用最终决定癌细胞的命运——是存活还是引发免疫性细胞死亡。此外,蛋白酪氨酸磷酸酶(PTP1B)定位于内质网,能调节包括受体酪氨酸激酶在内的多种受体,且已知在HER2阳性乳腺癌中起关键作用。缺乏PTP1B的HER2+癌细胞在低氧条件下对细胞死亡更为敏感。
2024年11月6日,发表在Nature上题为A mechanism for hypoxia-induced inflammatory cell death in cancer的研究深入分析了PTP1B、RNF213及其下游的细胞信号通路,以理解在低氧诱导的炎症性细胞死亡中RNF213的作用。

文章要点
1) PTP1B与RNF213的相互调控:研究发现,PTP1B缺乏或抑制使得HER2+乳腺癌细胞在低氧条件下对细胞死亡敏感性增加。PTP1B通过调控RNF213的酪氨酸磷酸化促进其寡聚化和RZ区域活性,从而增强细胞的低氧响应。
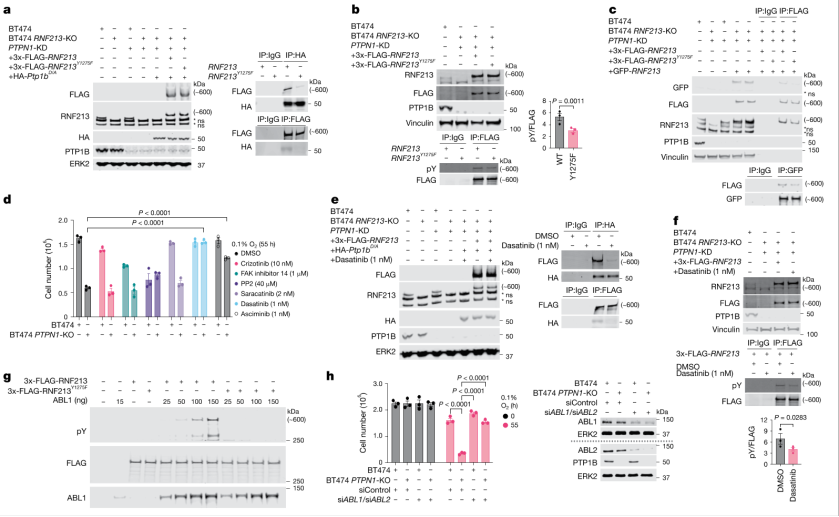
图1 PTP1B与RNF213的相互调控
2) CYLD/SPATA2的降解:RNF213的RZ结构域促使NF-κB关键调控因子CYLD和其协同蛋白SPATA2的泛素化和降解。CYLD和SPATA2的缺失会引发NF-κB的激活,从而诱导NLRP3炎症小体,协同内质网应激引发细胞的炎症性死亡(即焦亡)。
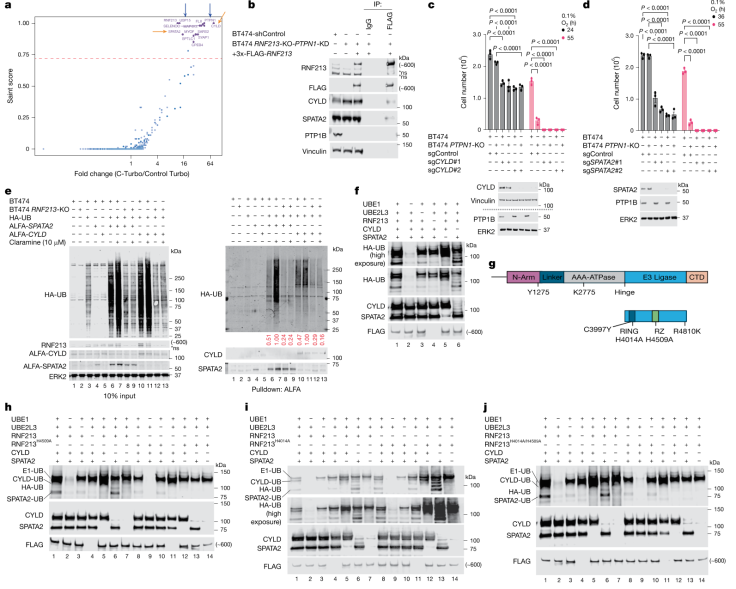
图2 CYLD/SPATA2的降解
3) RNF213突变体的功能验证:通过使用RNF213不同突变体的重组实验,研究进一步确认了RZ区域在肿瘤细胞死亡中的关键作用。突变后的RNF213缺乏RZ活性则不能引发CYLD/SPATA2的降解和低氧条件下的细胞死亡。
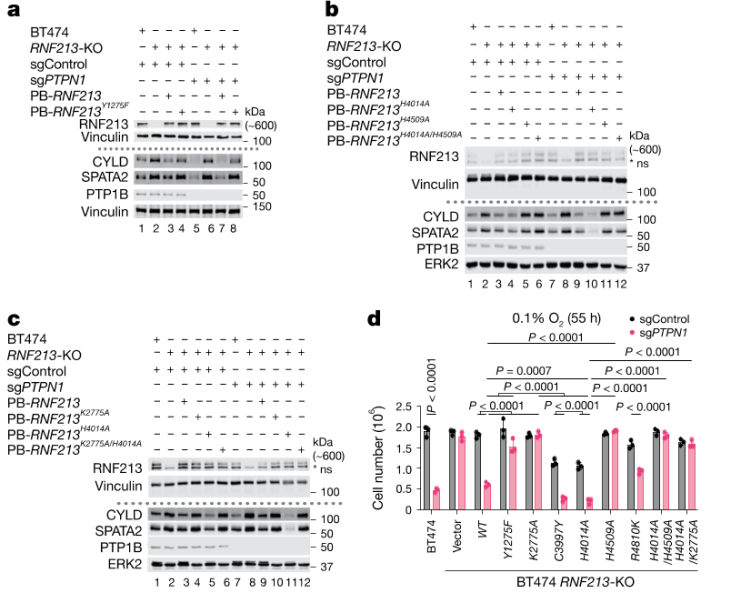
图3 RNF213突变体的功能验证
4) 炎症性信号的激活:CYLD和SPATA2的降解导致NF-κB和NLRP3炎症小体的激活,后者在低氧条件下的内质网应激刺激下被激活,引发焦亡性细胞死亡。
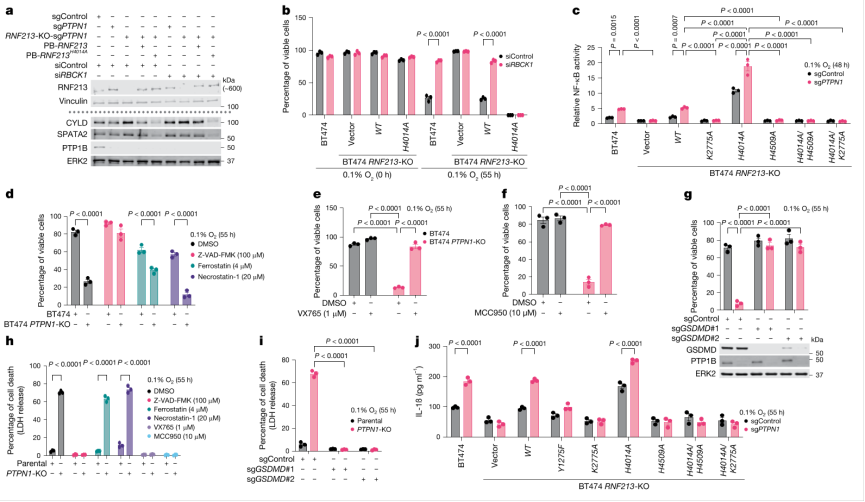
图4 炎症性信号的激活
5) 炎症性细胞死亡的依赖性:研究指出该机制依赖NF-κB和NLRP3的炎症小体激活。NF-κB启动细胞的“焦亡前期”,而内质网应激信号则作为“第二信号”完全激活炎症小体,最终导致焦亡。
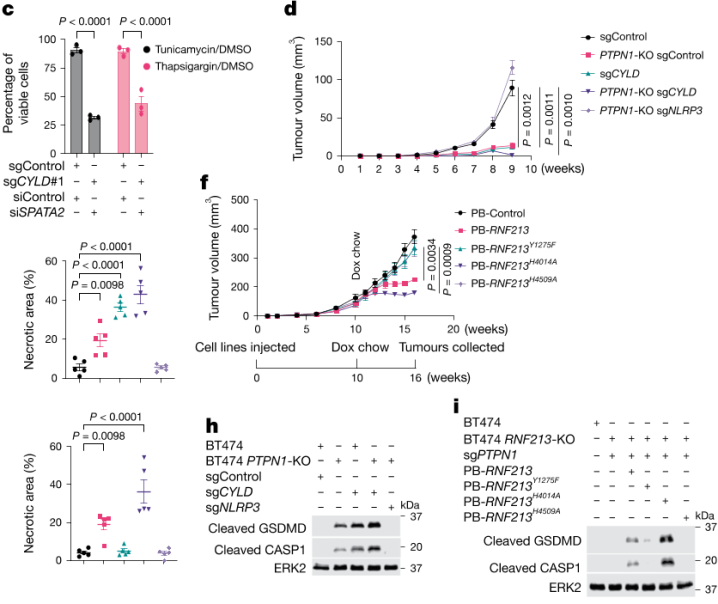
图5 炎症性细胞死亡的依赖性
该研究揭示了PTP1B-RNF213-CYLD-SPATA2轴在癌细胞低氧诱导的炎症性细胞死亡中的核心作用,并指出了PTP1B缺乏可以引发炎症性细胞死亡的可能性。此研究为理解癌症的低氧耐受和免疫逃逸机制提供了新视角,同时展示了RNF213作为潜在治疗靶标的可能性。通过调节RNF213的活性,有望开发出能够诱导肿瘤细胞焦亡的治疗策略,从而改善癌症治疗的效果。



