Nature:单细胞测序揭示炎症促进细胞纤维化机制
时间 : 2024-11-28单细胞测序网讯:2024年10月23日,格拉德斯通研究所Deepak Srivastava团队在Nature上发表了题为“Chromatin remodelling drives immune cell–fibroblast communication in heart failure”的研究论文,本研究表明,在浸润的Cx3cr1+巨噬细胞中,条件删除转录共激活因子Brd4可改善小鼠心力衰竭,并显著降低成纤维细胞的激活。在Cx3cr1+细胞中单细胞染色质可及性和BRD4占用分析发现了的IL-1β附近的一个大增强子,以及一系列基于crispr的缺失揭示了控制IL-1β表达的精确的应力依赖性调节元件。分泌的IL-1β激活了转录因子MEOX1附近的成纤维细胞依赖性(也称为p65)增强子,导致人类心脏成纤维细胞的纤维化反应。在体内,抗体介导的IL-1β中和可改善心力衰竭患者的心功能和组织纤维化。在Cx3cr1+细胞中,系统性IL-1β抑制或靶向IL-1β缺失可阻止应激诱导的Meox1表达和成纤维细胞激活。通过IL-1β阐明特定免疫细胞亚群和成纤维细胞之间brd4依赖的串导,揭示了炎症如何驱动促纤维化细胞状态,并支持在心脏病和其他以组织重塑为特征的慢性炎症疾病中调节这一过程的策略。

作者利用单细胞RNA测序技术,探讨了压力过载诱导的心力衰竭过程中,不同心脏细胞类型的转录动态变化,以及BET受体抑制剂JQ1的保护作用。纤维细胞和髓样细胞表现出最强的转录响应,与心功能变化高度相关。髓样细胞中存在一个亚群,表达细胞因子、趋化因子等促炎基因,并且这些基因在心力衰竭时上调,JQ1处理后下调。细胞亚群分析发现,JQ1抑制了来源于循环的单核细胞衍生的巨噬细胞,而对组织固有性巨噬细胞无影响。JQ1处理可下调髓样细胞中与炎症调节相关的基因,如细胞因子和趋化因子的生成及巨噬细胞激活等。总之,该研究从单细胞水平揭示心力衰竭发生过程中不同心脏细群的转录动态变化,并发现BET抑制剂JQ1通过调控促炎性髓样细胞亚群发挥心脏保护作用(图1)。
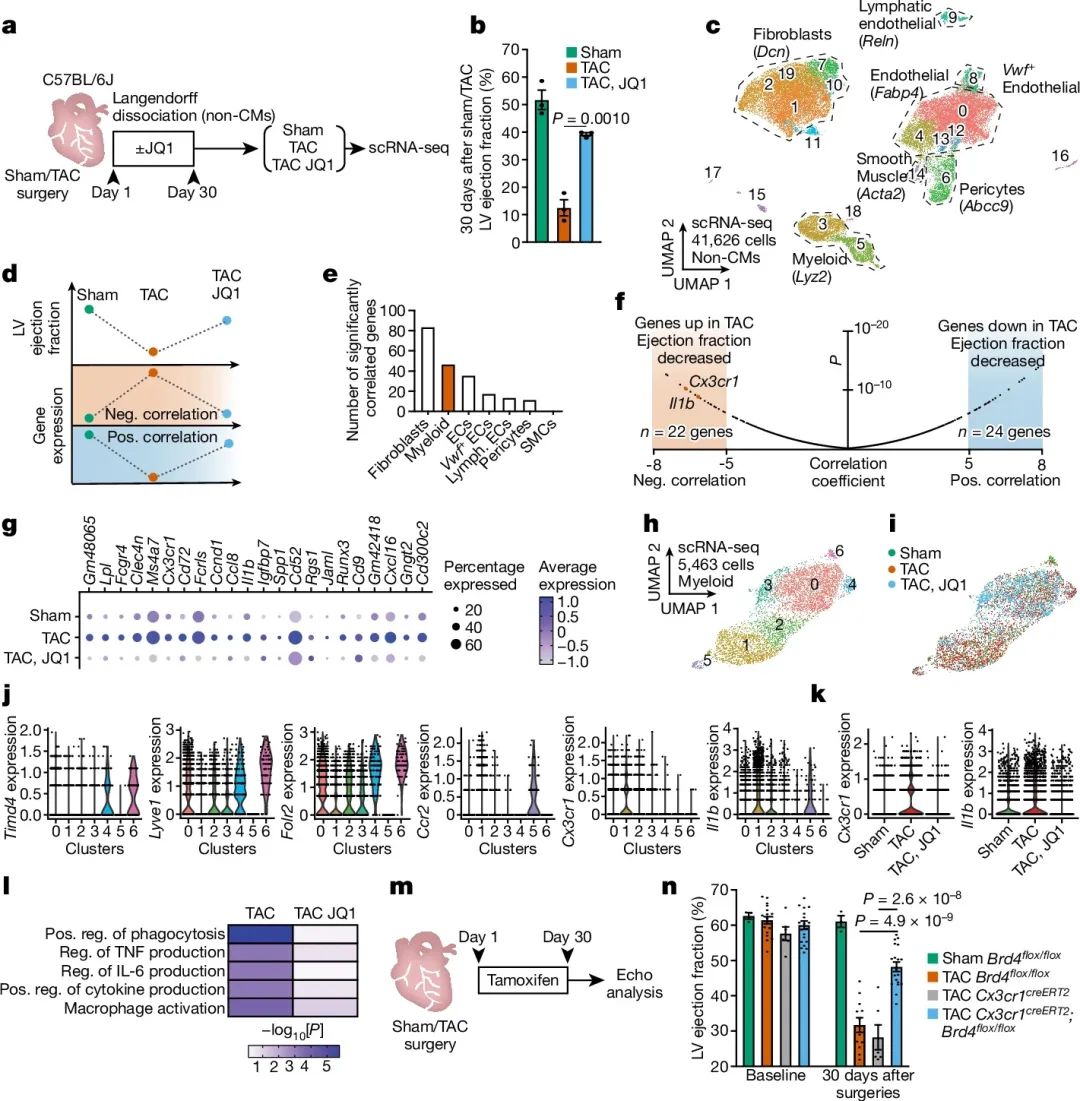
图1 Cx3cr1+髓样细胞在心力衰竭中的作用
通过敲除Cx3cr1+细胞中的BRD4,可以改善压力超负荷诱导的心功能损害和心肌纤维化。作者选择性地敲除驻留性Cx3cr1+巨噬细胞中的BRD4,发现这一过程不会显著改善心功能,说明BRD4在循环单核细胞/巨噬细胞中的作用更为关键。单细胞RNA测序分析发现,BRD4敲除可以降低由TAC诱导的单核细胞/巨噬细胞亚群中的炎症相关基因表达,包括Il1b、Ccr2等。特别是Il1b基因在一个特定的单核细胞/巨噬细胞亚群中表达较高,并且其表达受心力衰竭诱导上调、BRD4敲除下调的调控。综上所述,BRD4通过调控Cx3cr1+细胞(主要是循环单核细胞/巨噬细胞)中的炎症反应,参与了心力衰竭发病机制(图2)。
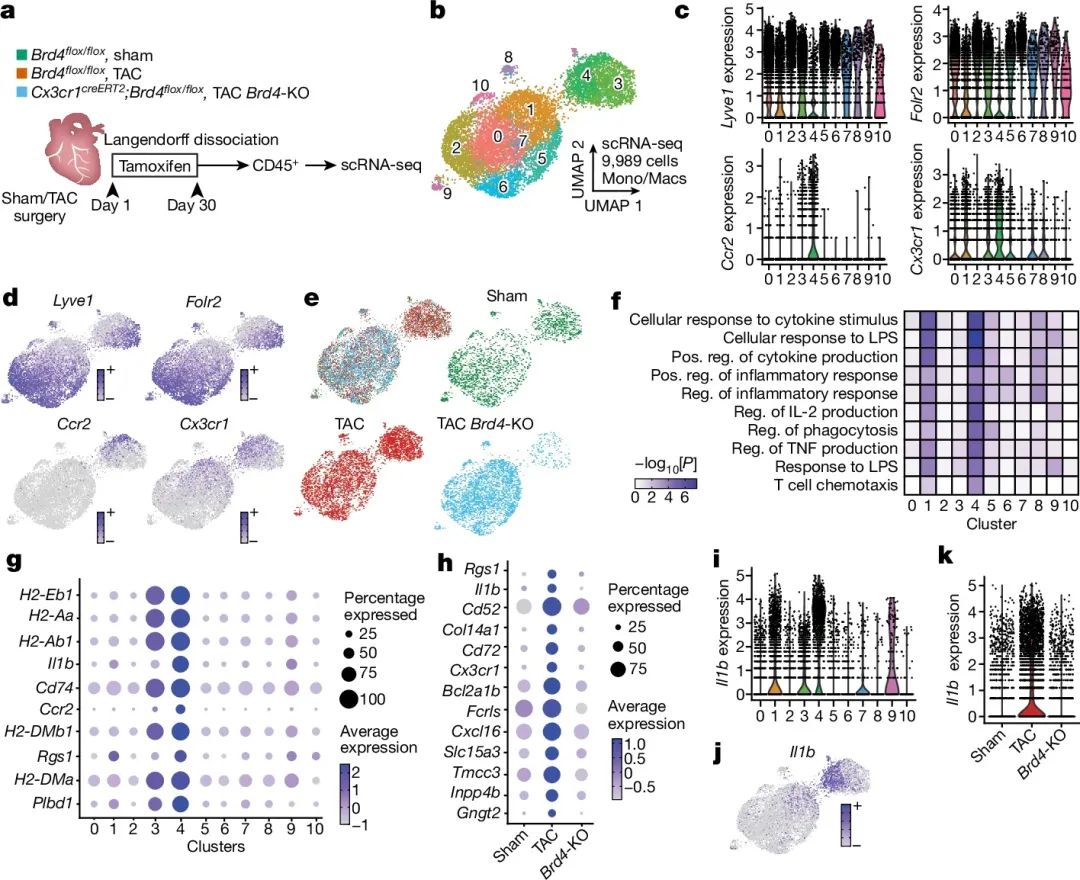
图2 心脏衰竭时Cx3cr1+细胞中的BRD4功能
单核细胞核RNA测序发现,在压力负荷下,Cx3cr1+细胞BRD4敲除不仅影响炎症相关基因的表达,也影响成纤维细胞的转录状态。在成纤维细胞群体中,存在一个特定的子群(簇6),其表达了多种成纤维细胞活化相关基因,如Postn、Meox1等,该子群在BRD4敲除组明显减少。转录差异分析显示,在压力负荷下,成纤维细胞中下调的基因多与细胞外基质和胶原纤维组织化等纤维化相关功能富集,而BRD4敲除可以抑制这些基因的表达。单细胞ATAC-seq分析发现,在BRD4敲除组,成纤维细胞中活化基因的染色质可及性减低,这些区域富集了多种与纤维化和炎症相关的转录因子结合位点。Postn和Meox1基因启动子区域在压力刺激下促进染色质开放,而BRD4敲除可降低这些区域的可及性。综上所述,BRD4在Cx3cr1+细胞中可以通过非细胞自主的方式,调节心肌成纤维细胞的基因表达和染色质重塑,从而参与到压力诱导的心肌纤维化过程(图3)。
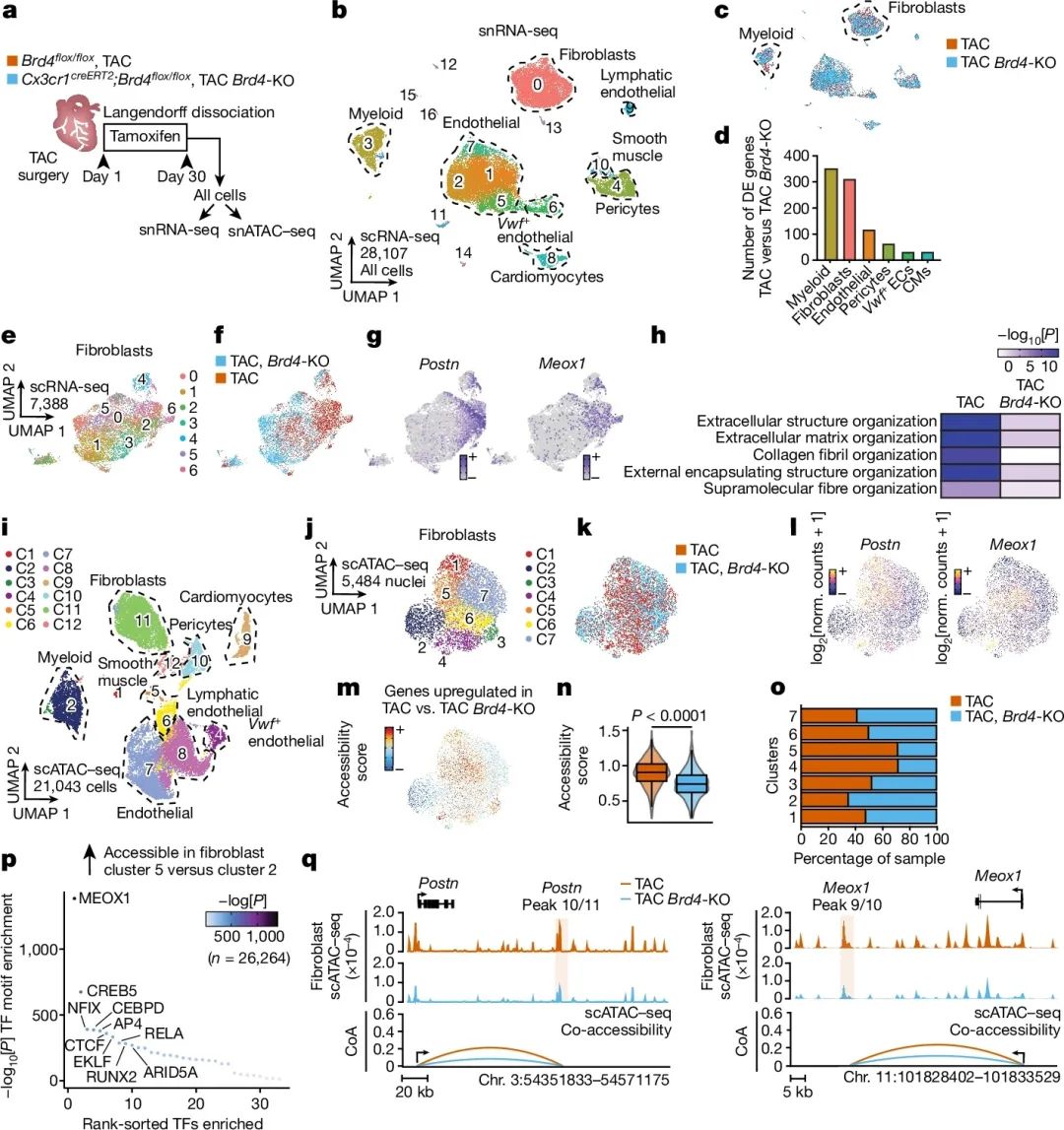
图3 Cx3cr1+细胞中的BRD4激活成纤维细胞
体外实验发现, IL-1β 能够促进人源性诱导多能干细胞衍生的心肌成纤维细胞 (iPSC-CFs) 表现出更强的收缩能力,这种效果在与 TGF-β 联合使用时更为显著。细胞培养基添加 IL-1β 中和抗体可以减弱巨噬细胞分泌 IL-1β 介导的成纤维细胞收缩。通过 ChIP-seq 发现,在人源性心肌成纤维细胞中,MEOX1 基因位点有 RELA 转录因子结合位点,RELA 和 BRD4 能协同调控 MEOX1 基因表达。敲低 RELA 可以抑制 TGF-β/IL-1β 诱导的 MEOX1 激活。体内实验中,在压力负荷模型下,用 IL-1β 中和抗体处理可以改善心脏功能,减少纤维化。scRNA-seq 分析发现,IL-1β 中和能够降低表达纤维化相关基因 (如 Postn、Meox1) 的成纤维细胞亚群的比例。进一步通过在 Cx3cr1+ 细胞中特异性敲除 Il1b,也观察到类似的成纤维细胞激活相关基因表达下调,进一步证明了 Cx3cr1+ 细胞分泌的 IL-1β 在调控成纤维细胞纤维化功能中的关键作用。综上所述,IL-1β 通过上调 MEOX1 转录因子参与了压力诱导下成纤维细胞的活化过程,这为靶向 IL-1β 信号通路的心力衰竭治疗提供了新的机制依据。(图4)。
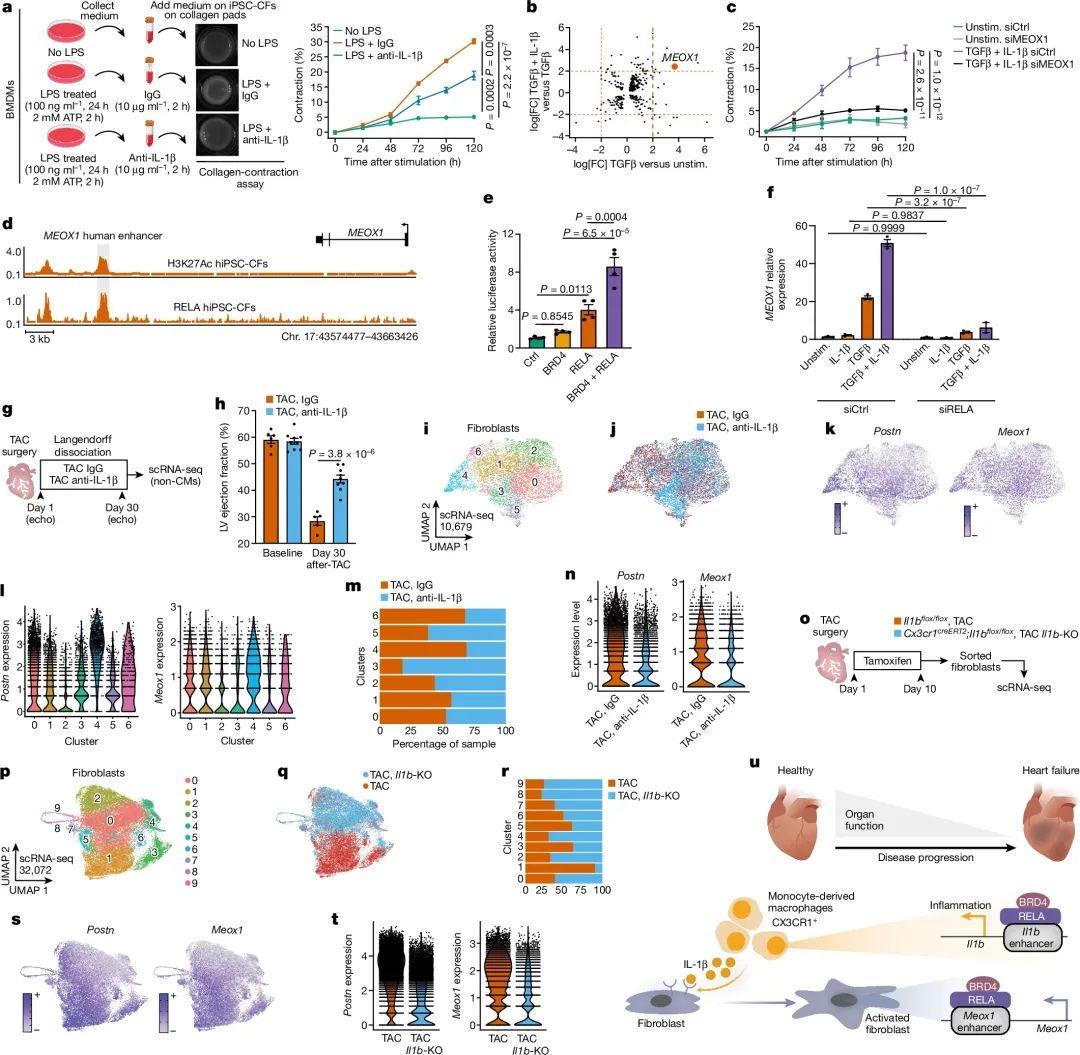
图4 IL-1β抑制或靶向IL1b缺失可阻止应激诱导的MEOX1表达和成纤维细胞活化
器官功能依赖于特定细胞类型之间的相互作用来维持体内平衡并对压力做出反应。在这里,作者发现BRD4在这些免疫细胞中调控了多种细胞因子的表达,包括关键的纤维化调控因子IL-1β。IL-1β通过作用于成纤维细胞上的受体IL1R1,激活了MEOX1转录因子,从而促进了成纤维细胞的功能活化和心脏纤维化过程。中和IL-1β或在Cx3cr1+细胞中敲除Il1b都能抑制压力诱导下成纤维细胞的激活,从而改善心脏功能。作者指出,通过将基因组学手段与细胞类型特异性的干预手段相结合,可以揭示器官功能维持和应激反应中不同细胞类型之间的关键交互作用,这种方法可以应用于其他疾病的研究。此外,针对特定细胞中的调控元件进行精准调控,可能是一种更安全有效的治疗策略,避免全身炎症抑制带来的副作用。



