Nature:糖皮质激素重塑线粒体代谢发挥抗炎作用
时间 : 2024-04-20糖皮质激素(GCs)是一类抗炎药物,也是治疗类风湿性关节炎、炎症性肠病和哮喘等各种免疫介导的炎症性疾病的重要药物。然而,人们对其抗炎作用的确切分子机制仍然知之甚少。
现在,来自埃尔朗根大学Gerhard Krönke教授领导的研究团队对此进行了更深入的研究。他们的研究成果于2024年4月10日以题为“Metabolic rewiring promotes anti-inflammatory effects of glucocorticoids”的形式发表在《Nature》期刊上。
该研究发现,糖皮质激素(GCs)的抗炎特性与其对巨噬细胞线粒体代谢的重塑有关,这种重塑导致抗炎代谢产物衣康酸的持续产生,进而抑制炎症反应。这些发现为开发副作用更少、更轻微的抗炎药物奠定了基础。

糖皮质激素(GCs)实际上是一种应激激素,以皮质醇的形式自然存在于体内。机体通过释放皮质醇以改善对应激的身体反应。
皮质醇干预糖和脂肪代谢,并影响其他参数,包括血压、呼吸和心率。在高剂量下,它还抑制免疫系统的活性。
由于其出色的疗效,合成的糖皮质激素衍生物在抑制炎症方面甚至比体内存在的天然物质更有效,被广泛用于治疗各种免疫介导的炎症性疾病。
然而,基于糖皮质激素的药物也有副作用,尤其是在高剂量和长时间给药时。这些副作用包括高血压、骨质疏松、糖尿病和体重增加。
为了开发副作用更少、更轻微的抗炎药物,Gerhard Krönke教授领导的研究团队现在对糖皮质激素如何发挥免疫抑制作用进行了更深入的研究。
在这项研究中,研究团队将重点放在巨噬细胞上,巨噬细胞是一种负责消灭病毒和细菌等入侵者的免疫细胞。这些细胞也可以在免疫介导的炎症疾病中发挥作用。
研究人员研究了这些免疫细胞(来源于小鼠)如何对炎症刺激做出反应的,以及额外给予糖皮质激素有什么影响。首先,研究人员对脂多糖(LPS)处理的骨髓源性巨噬细胞(BMDMs)进行了RNA-seq分析,结果显示GC对LPS诱导的mRNA转录具有时间依赖性的影响。
重要的是,KEGG分析表明GC不仅调节了炎症通路,还调节了LPS激活的巨噬细胞的代谢通路包括线粒体氧化磷酸化、丙酮酸代谢和三羧酸(TCA)循环活性。
进一步实验发现,GC诱导LPS激活的巨噬细胞中的乳酸减少和乙酰辅酶A增加,线粒体呼吸增加,促进炎症巨噬细胞的线粒体重塑。
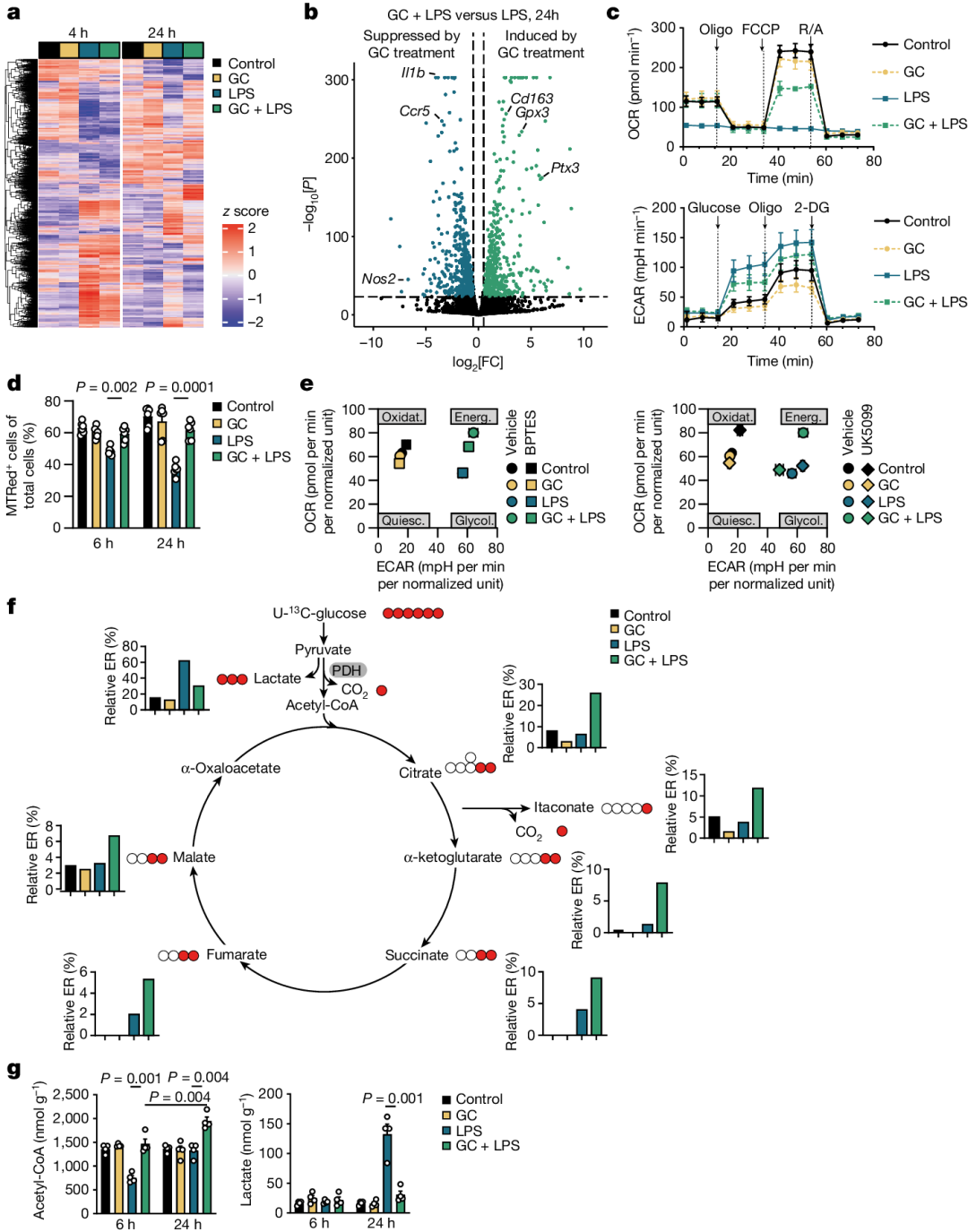
研究人员发现糖皮质激素受体(GR)核定位序列(NLS)的突变消除了GC诱导的C1qb、Cd163和Fkbp5 mRNA的表达,这表明GR的核转位是GC诱导的转录激活所必需的。
尽管GR NLS突变消除了GC诱导的转录,但它并没有消除GC诱导的线粒体膜电位稳定化和线粒体呼吸的增加,这表明GC诱导的线粒体代谢重塑不依赖于GR的基因组效应。
通过共免疫沉淀和近邻连接分析,研究人员发现糖皮质激素受体(GR)与丙酮酸脱氢酶(PDH)的某些亚基(如PDHX)在细胞质中存在相互作用。在GC处理后,GR从PDH-GR复合物中释放出来,导致PDHX等亚基的线粒体易位增加。PDHX在线粒体内的积累显著增加,同时PDH和丙酮酸羧化酶(PC)的活性也显著增强。这最终加速了LPS激活的巨噬细胞中的TCA循环,为炎症状态下的细胞提供能量。
此外,研究人员还发现糖皮质激素处理后,巨噬细胞的线粒体体积增加,但PDH蛋白总量保持稳定。研究人员通过使用特异性抑制剂,发现糖皮质激素诱导的PDH和PC活性增强是线粒体代谢重塑的关键步骤。
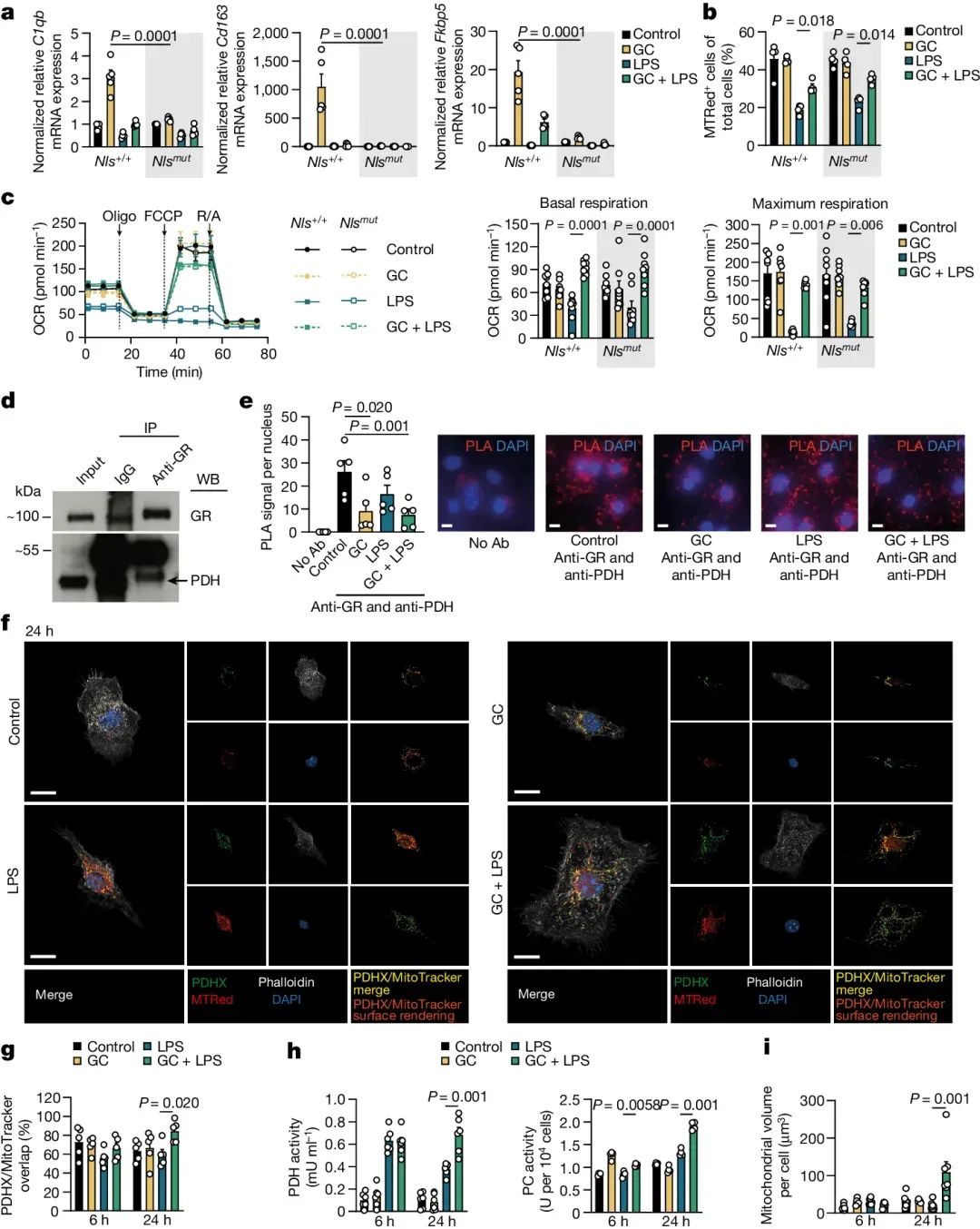
之后,研究人员研究了GC诱导的代谢重塑是否与LPS激活的巨噬细胞中GC的抗炎作用相关。
研究人员将巨噬细胞暴露于低氧(1% O2)条件或通过脯氨酰羟化酶抑制剂RXD处理和线粒体丙酮酸转运蛋白抑制剂UK5099处理,结果发现,阻断PDH活性或抑制PDH亚基的线粒体易位则显著减弱了糖皮质激素的抗炎作用,说明GC诱导的线粒体代谢重塑是GC诱导抗炎作用的关键机制。
以上这些实验数据和发现共同表明,GC通过一种非基因组机制,即不依赖于基因转录,来调节巨噬细胞的代谢,进而影响其炎症状态。
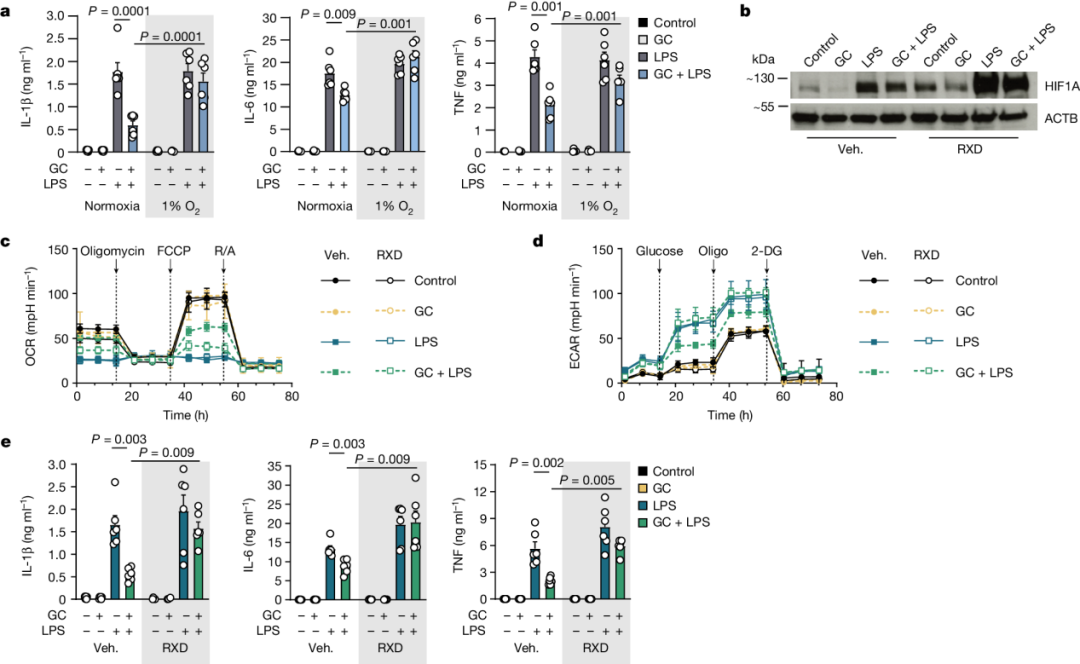
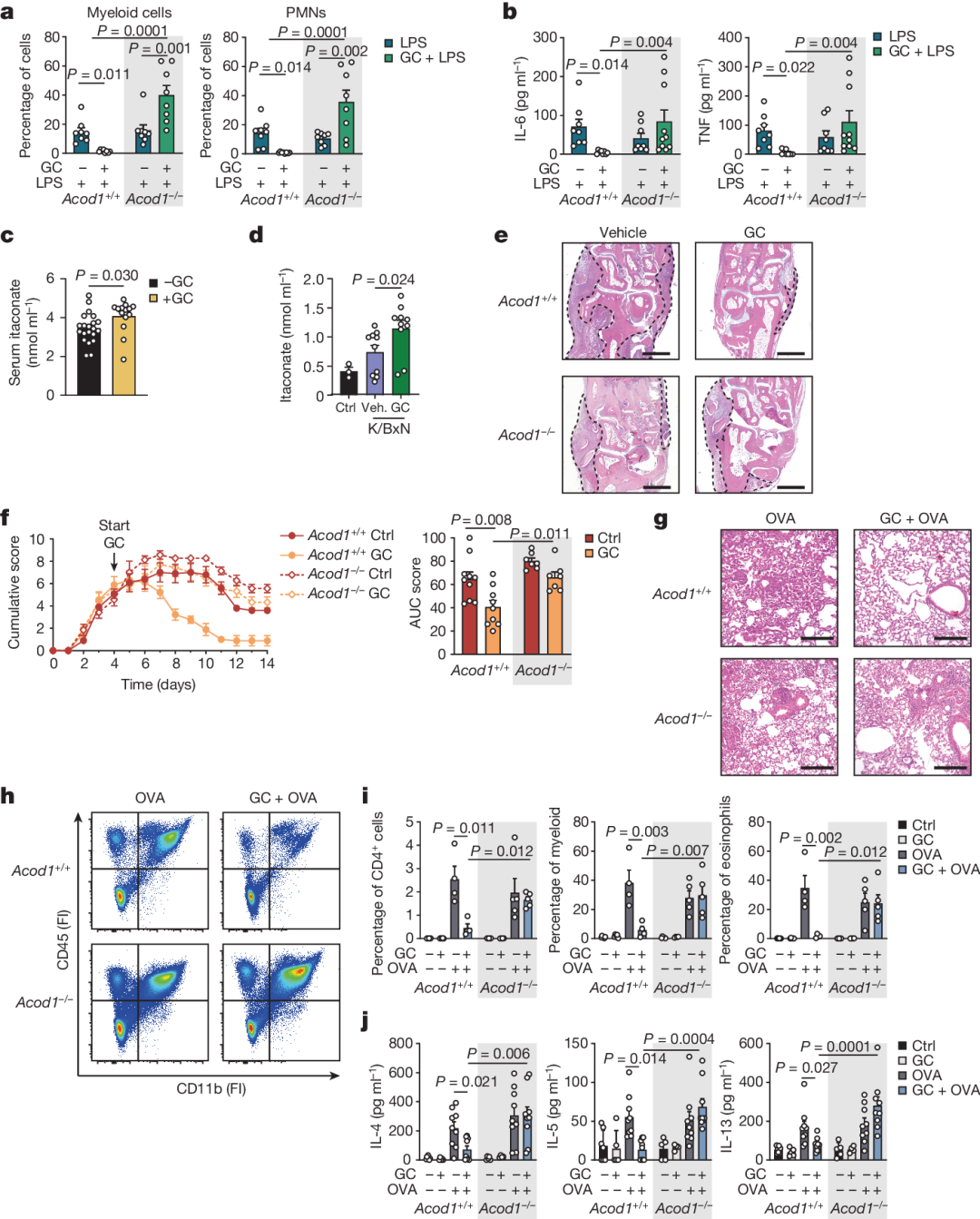
为了识别和量化TCA循环衍生的代谢物,研究进行了代谢组学分析。
结果显示,LPS诱导后,巨噬细胞中多种TCA循环代谢物(如柠檬酸、富马酸、苹果酸)增加。然而,在GC处理后,这些代谢物的增加被逆转,除了衣康酸和琥珀酸。
研究人员发现,LPS处理6小时后,衣康酸水平出现早期峰值,随后在LPS处理24小时后显著降低。GC处理24小时后,衣康酸水平显著增加。
敲除ACOD1(乌头酸脱羧酶1,衣康酸合成的关键酶)基因后,GC处理未能增加衣康酸水平。
这些实验数据表明,GC处理通过维持LPS激活的巨噬细胞中TCA循环衍生的ACOD1底物供应,而不是直接影响ACOD1的表达,来促进衣康酸的产生。
衣康酸主要在线粒体中合成,是一种三羧酸循环(TCA循环)的中间产物。最近的研究表明,衣康酸在巨噬细胞和其他免疫细胞中具有重要的抗炎作用,能够抑制促炎细胞因子的表达和炎症信号通路的激活,从而发挥抗炎作用。
为了进一步探索所确定机制的体内相关性,最后,研究人员研究了糖皮质激素治疗在各种免疫介导的炎症性疾病小鼠模型中的作用,包括LPS诱导的急性肺损伤小鼠模型、K/BxN血清转移性关节炎小鼠模型(一种类风湿性关节炎模型)和卵清蛋白诱导的过敏性气道炎症小鼠模型(一种哮喘模型)。
结果显示,GC治疗完全预防了野生型小鼠LPS诱导的肺部炎症,而ACOD1缺陷小鼠仍经历了严重的肺部炎症。这证实,衣康酸的产生对于GC诱导的体内抗炎作用至关重要。
此外,在K/BxN血清转移性关节炎小鼠模型和卵清蛋白(OVA)诱导的过敏性气道炎症的小鼠模型也观察到同样的结果。
重要的是,研究人员还发现,类风湿性关节炎患者的糖皮质激素治疗效果与血清中衣康酸水平升高有关,这进一步支持了这一机制的临床相关性。
总的来说,这项研究深入解析了糖皮质激素抗炎的机理,对糖皮质激素的抗炎机制有了更为清晰的认识。研究发现,糖皮质激素能够通过激活巨噬细胞线粒体代谢的基因表达调控之外的非基因组途径,从而推动抗炎代谢产物衣康酸的持续生成。这一持续生成过程是糖皮质激素在治疗各种由免疫介导的炎症性疾病中发挥积极作用的核心机制。
这些发现对新型抗炎药的设计具有重要意义。如果衣康酸介导糖皮质激素的免疫抑制作用,那么是否可以通过直接给药衣康酸,而不是糖皮质激素?
Krönke解释道:“不幸的是,衣康酸不是一种特别好的抗炎药,因为它不稳定,而且由于其高反应性,如果全身给药,可能会引起副作用。除此之外,我们认为人体中的过程比小鼠中的过程要复杂一些。所以,我们计划寻找新的合成化合物,这些化合物在免疫细胞内部重新编程线粒体代谢方面与糖皮质激素一样有效,但副作用更少、更轻微。”



