Embo Reports:TFEB的线粒体易位调控炎症反应
时间 : 2024-01-26TFEB的核活性依赖于哺乳动物雷帕霉素靶点(mTOR),在营养丰富的条件下,TFEB的Ser 122、Ser142和Ser211位点发生磷酸化,这促进其与14-3-3接头蛋白的结合,并阻止其核易位和转录活性[1];相反,在溶酶体应激和饥饿期间抑制mTOR会导致TFEB磷酸化水平的降低,从而促进其核易位和转录功能;TFEB也被证明与mTOR在溶酶体表面共定位,以RAG-GTPase依赖的方式,除了作为溶酶体转录“效应”的既定作用外,还作为溶酶体“传感器”[2]。
既往文献报道称,线粒体电子传递复合体功能与TFEB之间存在关键联系;TFEB转录调控参与线粒体生物发生和葡萄糖摄取的基因,TFEB的缺失导致形态异常和功能失调的线粒体的积累。不过,TFEB对线粒体功能的直接非转录作用尚未被阐明。
通过TFEB有效上调自噬体和溶酶体是异源自噬和破坏细胞内病原体所必需的,这构成了一种必要的先天免疫反应,TFEB通过秀丽隐杆线虫中保守的转录程序调节巨噬细胞感染后的炎症和免疫[3],另有数据表明线粒体代谢可能有助于TFEB激活的巨噬细胞的效应功能。
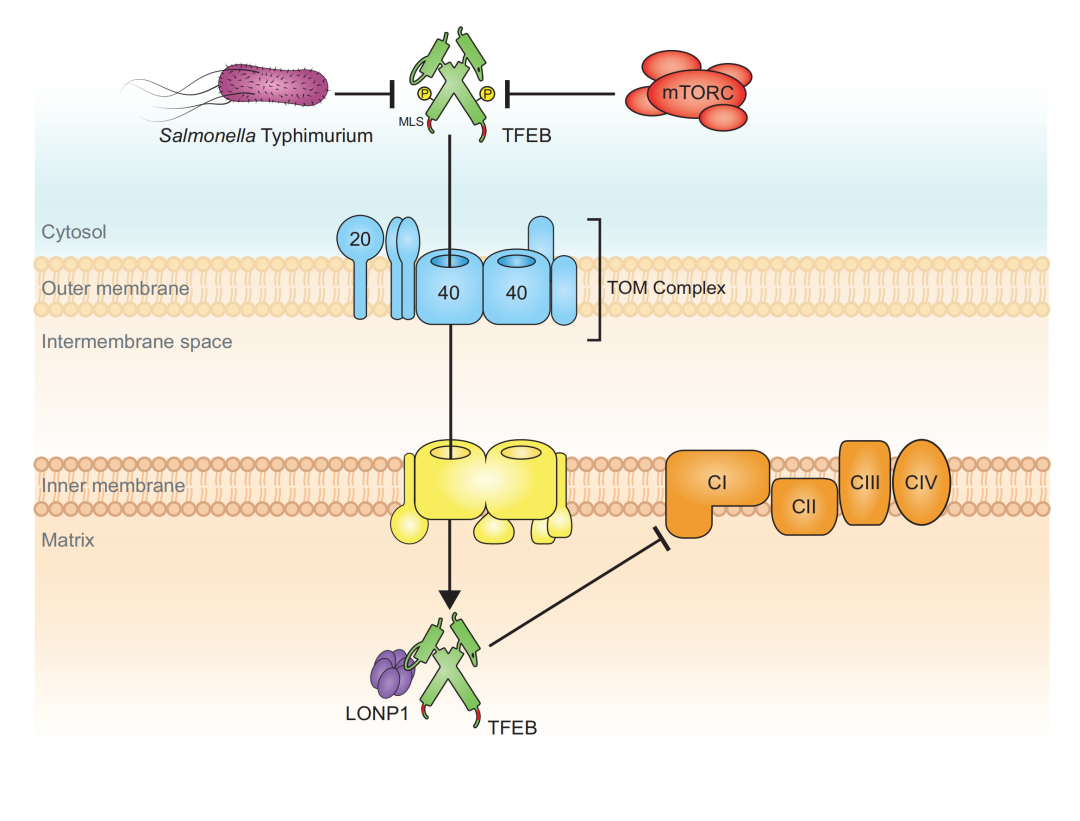
2024年1月23日,来自德国科隆大学的Adam Antebi团队和Nirmal Robinson团队联合在杂志Embo Reports上发表了题为Mitochondrial translocation of TFEB regulates complex I and inflammation的文章,发现TFEB通过一个Tomm20结合基序与LONP1形成一个复合物,以调节电子传递复合体I;线粒体ROS的产生与由TFEB直接调节的先天免疫防御之间存在直接联系。

-
TFEB定位于线粒体基质
为了以无偏倚的方式识别TFEB的新功能,团队进行了高亲和力质谱分析,鉴定未感染细胞与鼠伤寒杆菌感染或Torin-1处理的细胞中与TFEB相互作用的蛋白。在一个由130个蛋白构成的高度动态的TFEB相互作用组中,有28个定位于线粒体,表明了TFEB在线粒体中的定位和功能。
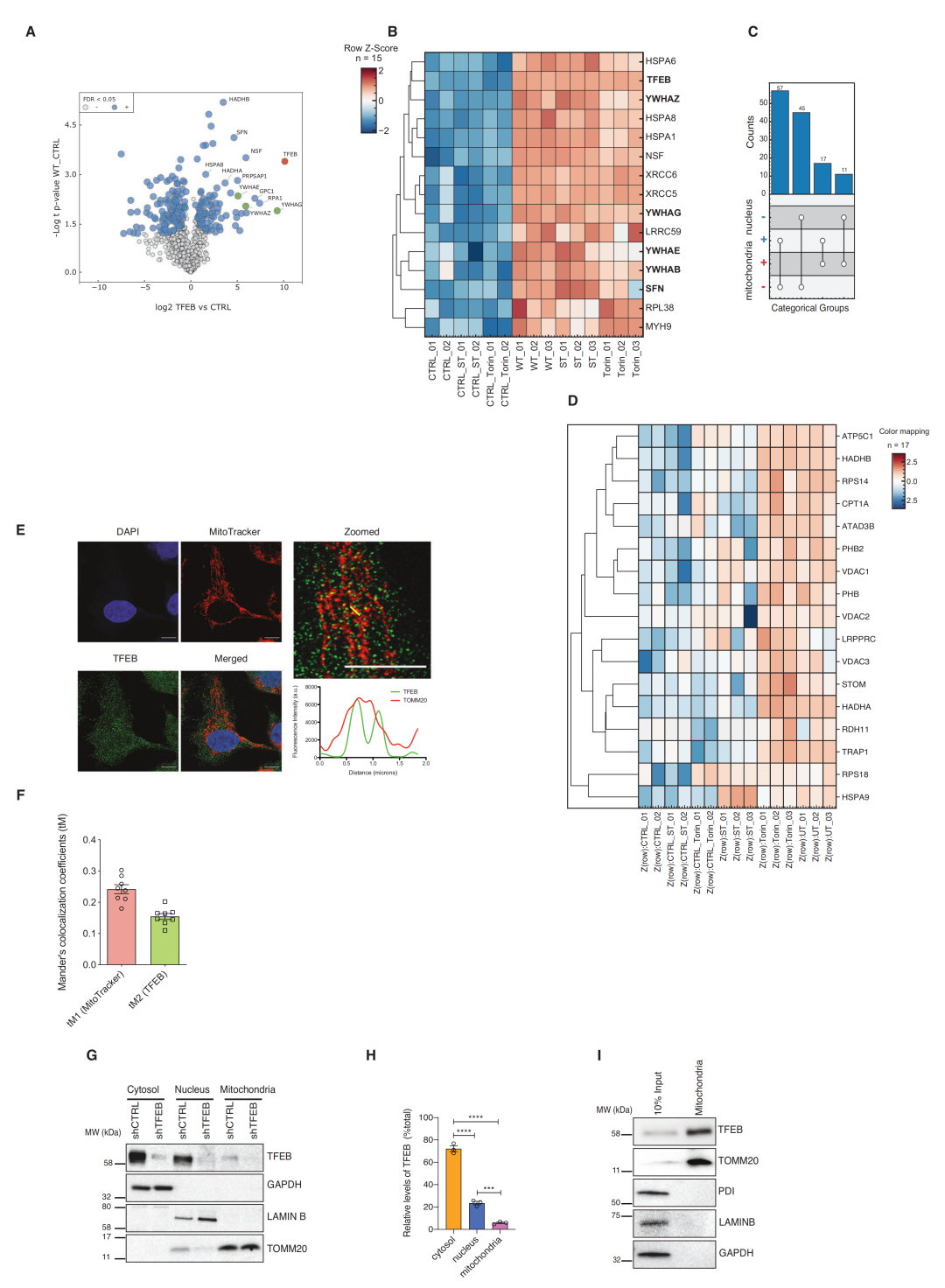
进一步研究发现,TFEB与mtDNA接近,但不直接与mtDNA结合,表明TFEB与mtDNA位于同一隔间;蛋白酶保护试验及电镜证明TFEB主要定位于线粒体基质。
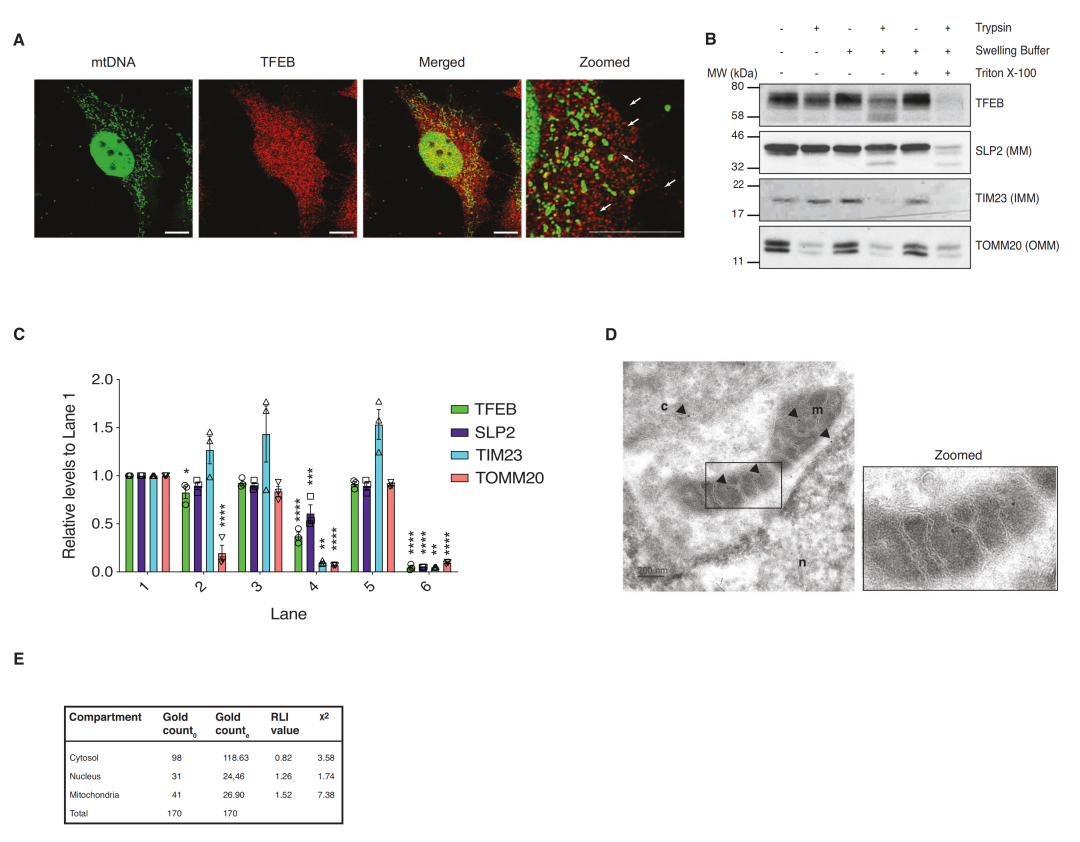
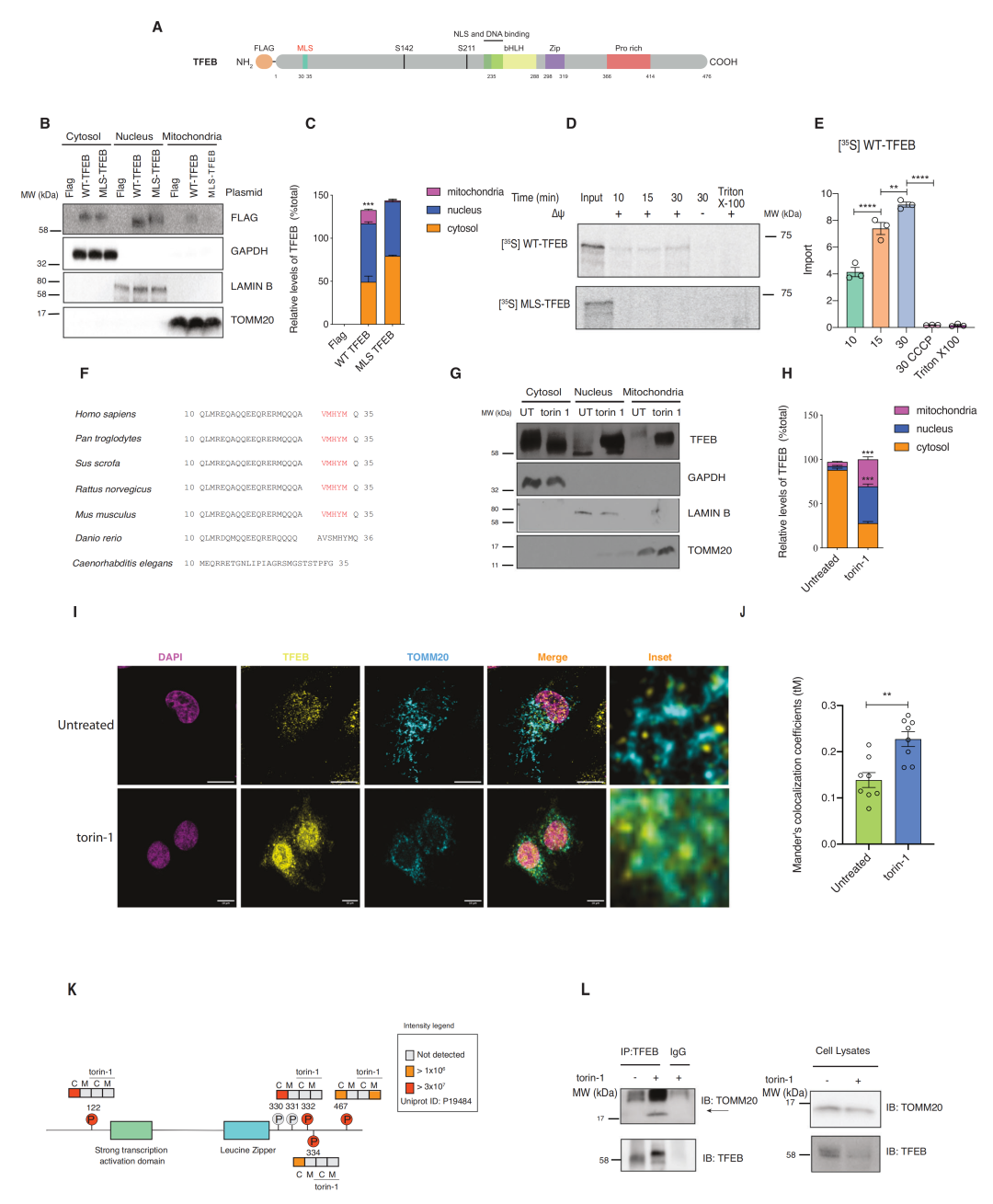
2.1 TFEB的线粒体定位信号(MLS)可以使线粒体易位
2.2 TFEB的线粒体易位依赖于mTOR
大多数到达线粒体基质的蛋白质都是用基质靶向序列(MTS)合成的。团队使用MitoProt II预测了TFEB的假定MTS,并生成了一个TFEB结构,并删除了假定的MTS(ΔMTS),以评估该结构域是否负责其线粒体易位。可惜的是,后续实验发现易位独立于预测的MTS。
团队还利用MitoFates在TFEB中发现了一个特定的TOMM20结合共识基序(VMHYM),将其称之为线粒体定位序列(MLS)。研究发现,TFEB以膜电位依赖的方式主动导入线粒体,因为CCCP处理显著减少了TFEB向线粒体的易位。然而,35S放射性标记的MLSTFEB体外翻译显示线粒体易位受损,进一步证明了MLS基序在线粒体输入中的功能。
由于溶酶体生物发生是TFEB的一个重要转录功能,团队通过分析其溶酶体靶基因的mRNA来询问MLS突变体是否保留了TFEB的转录活性。他们发现TFEB的转录活性在MLS-TFEB转染的细胞中不受影响。
由于TFEB的核易位是依赖于mTOR的,团队研究了TFEB的线粒体定位是否也显示了mTOR的调控。研究发现,内源性TFEB和TOMM20共定位在Torin-1处理后增加。
已知TFEB亚细胞定位是由mTOR依赖的TFEB残基Ser122、Ser142和Ser211的磷酸化介导的,于是团队通过质谱法研究了HeLa细胞中线粒体(M)中TFEB对总细胞裂解液(C)的磷酸化状态。有趣的是,线粒体中存在的TFEB池在已确定的磷酸化位点(Ser122、Ser332和Ser334)上没有被磷酸化,在Torin-1处理后,TFEB在这些Ser残基上的磷酸化失效了;然而,Ser467是Torin-1处理后在线粒体池中检测到的唯一磷酸化残基。已知Ser467磷酸化负责TFEB的胞质稳定,因为它可以独立于mTORC1阻止TFEB的核易位。上述结果表明,抑制mTOR可以使TFEB的去磷酸化池易位到线粒体中,这依赖于已确定的MLS基序。
3. TFEB的缺失会破坏线粒体的形态和功能
接下来,团队探究了TFEB缺失是否会对线粒体形态和功能产生影响。他们发现在TFEB缺失的细胞中,线粒体不对称地聚集在核周区域。Seahorse及后续研究发现TFEB在调节线粒体氧化磷酸化方面具有线粒体特异性的功能,线粒体呼吸能力受线粒体定位TFEB的调节,线粒体基因的转录不依赖于TFEB。
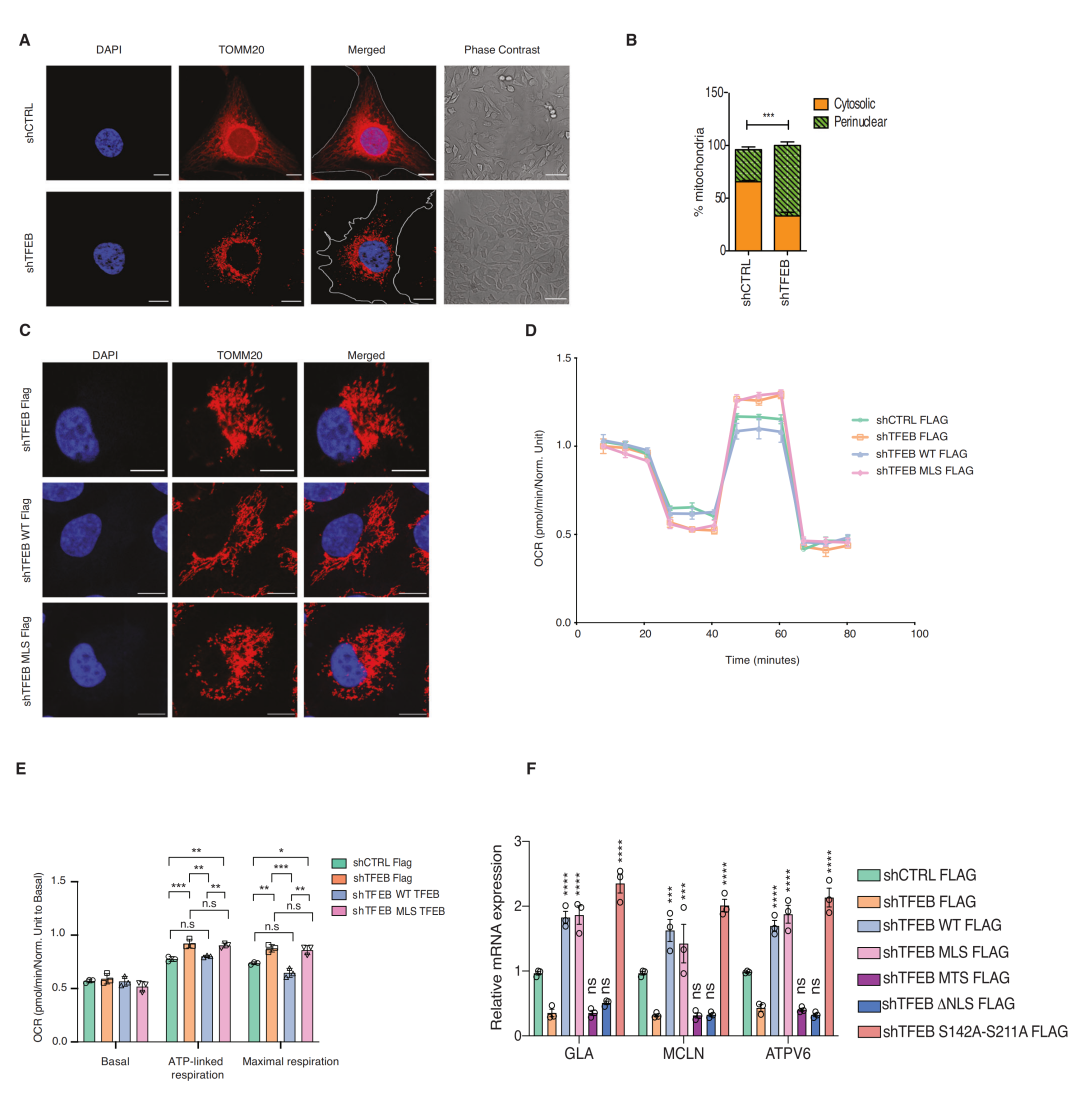
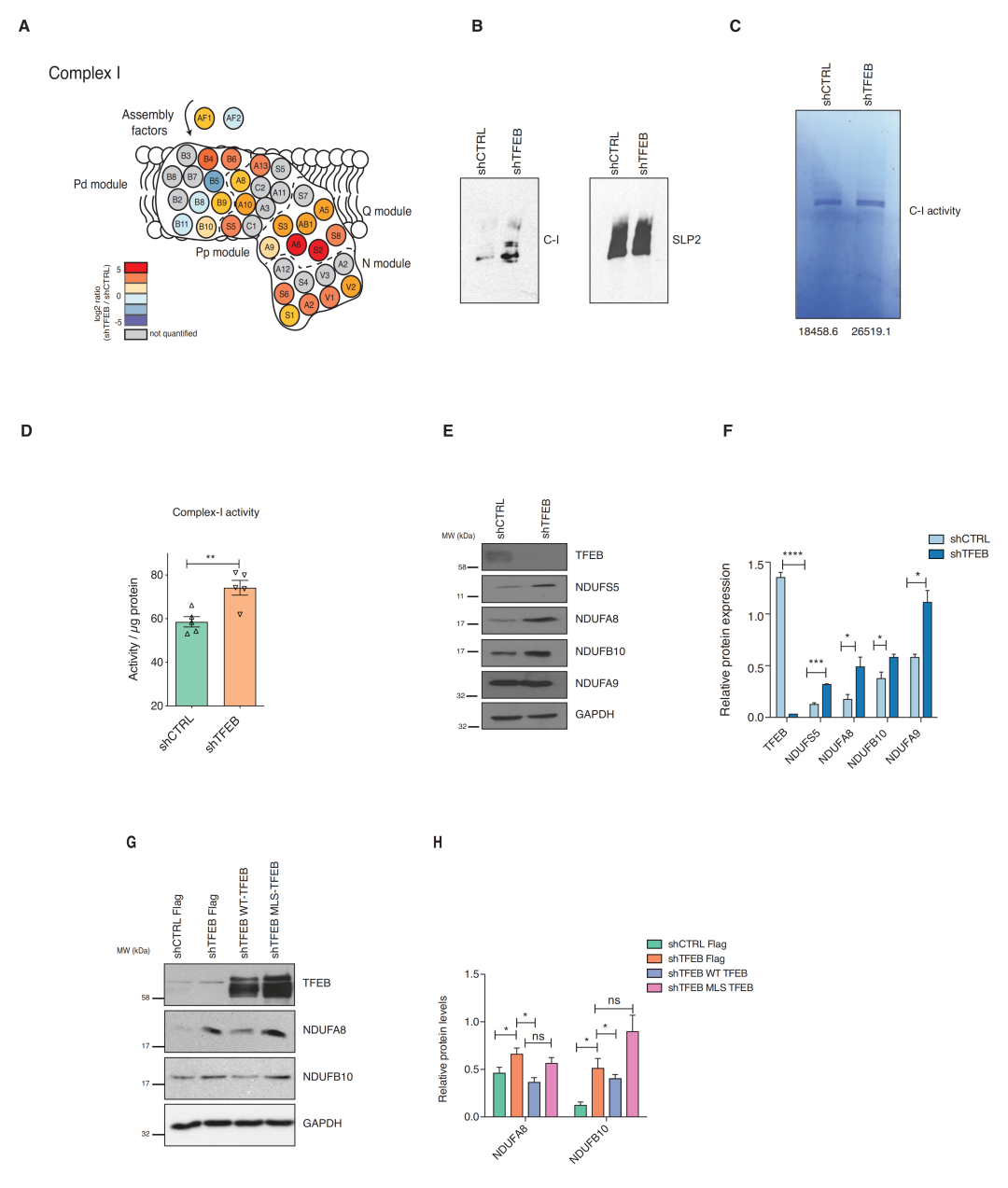
4. 在TFEB缺失的细胞中,线粒体复合体I的组装发生了改变
为了解线粒体TFEB如何调节线粒体功能,团队进行了无标记蛋白质组学研究,以确定线粒体蛋白表达的改变。他们发现在TFEB缺失的细胞中,复合物I亚基的表达总体上有所增加,而与特定的复合物I模块无关。
研究发现,TFEB调控的复合物I的功能是线粒体特异性的,且TFEB调控的线粒体自噬不依赖于线粒体TFEB。
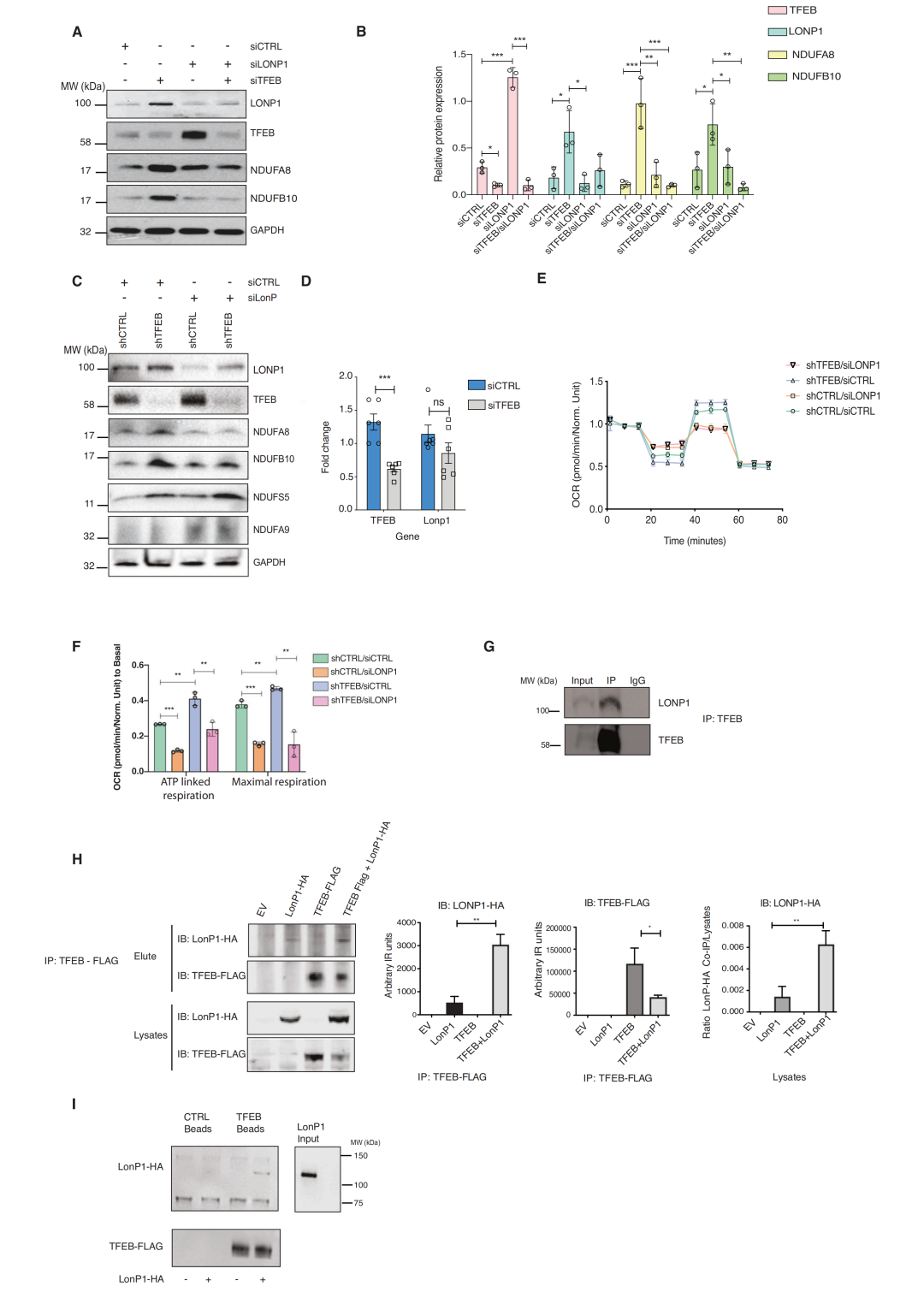
5. TFEB和LONP1共同调控复合物I
线粒体复合体的周转率受到伴侣蛋白和线粒体蛋白酶的调节。既往研究发现,丝氨酸线粒体蛋白酶LONP1通过调节其亚基来控制复合物I。
团队前续的蛋白质组学结果也确定了LONP1是与TFEB免疫沉淀的相互作用子之一。进一步研究发现TFEB与LONP1形成复合物调节复合物I,从而调节线粒体功能TFEB和LONP1协同调节线粒体氧化磷酸化。
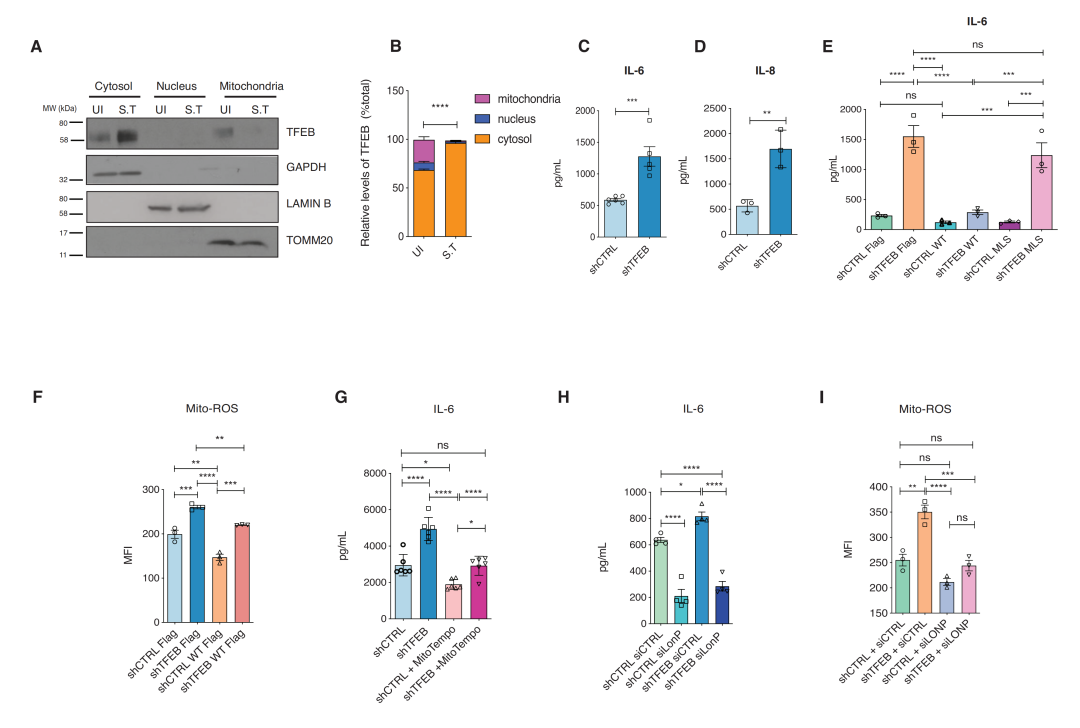
6. 线粒体TFEB调节鼠伤寒杆菌感染时的炎症反应
团队既往已经证明了鼠伤寒沙门氏菌可以防止自噬,破坏线粒体,诱导炎症并引发TFEB丢失的表型。他们推测TFEB在鼠伤寒杆菌感染期间可能发生了失调。
研究发现,鼠伤寒杆菌阻止了TFEB核易位,在鼠伤寒杆菌链球菌感染时,TFEB和线粒体蛋白之间的相互作用丢失。
TFEB已被证明在感染过程中可以转录调节细胞因子的表达;因此,团队接下探究TFEB的胞质定位是否会影响鼠伤寒杆菌感染期间的炎症结果。他们发现在TFEB缺失的细胞中,IL-6、IL-8和IL-1α的mRNA水平均显著上调,研究发现,TFEB介导的炎症调控也依赖于其线粒体定位;且在没有TFEB的情况下,mtROS是炎症的关键介质。TFEB的缺失增强了mt-ROS介导的鼠伤寒杆菌感染的炎症,这依赖于LONP1调控的线粒体复合物I。
7. 总结
TFEB是自噬、溶酶体生物发生、线粒体代谢和免疫的主调节因子,主要通过细胞质到核易位控制的转录发挥作用。新出现的数据表明,在细胞器表面有额外的调节相互作用。
本文中,团队发现TFEB在线粒体中具有非转录作用,调节电子传递链复合物I来下调炎症反应。蛋白质组学分析显示,广泛的TFEB与一些线粒体蛋白共免疫沉淀,它们的相互作用在感染鼠伤寒杆菌时被破坏。高分辨率共聚焦显微镜和生物化学证实了TFEB在线粒体基质中的定位。TFEB的易位依赖于一个保守的N端TOMM20结合基序,并通过mTOR抑制而增强。
在线粒体内,TFEB和蛋白酶LONP1拮抗地共同调节复合物I、活性氧和炎症反应。因此,在感染过程中,线粒体中特异性TFEB的缺乏加剧了促炎细胞因子的表达,促进了先天免疫发病机制。