Science:Kuffer合胞体在纤维化肝脏补充巨噬细胞功能
时间 : 2023-09-20
2023年9月8日,加拿大卡尔加里大学Paul Kubes教授团队在Science上发表题为: Spatial predictors of immunotherapy response in triple-negative breast cancer的研究性论文。库普弗细胞(KCs)定位于肝窦,但将假足延伸到实质细胞以维持其身份,并充当身体的中央细菌过滤器。肝硬化极大地改变了血管结构,但KCs如何适应尚不清楚。
作者用小鼠肝纤维化模型和人体组织来检测免疫适应性。纤维化使KCs失去与实质细胞的接触,下调了“KC特性”,使它们无法清除细菌。共生体通过CD44刺激单核细胞招募到一个空间不同的血管腔室。在那里,招募的单核细胞形成了多核细胞(合胞体)的大聚集,表达KC标记物并显示出增强的细菌捕获能力。合胞体通过CD36形成,并在人类肝硬化中被观察到,这可能是一种随着纤维化而演变的抗微生物防御。

局部环境是在一个给定的器官建立巨噬细胞表型的关键。在肝脏中,巨噬细胞在由肝细胞、内皮细胞和星状细胞组成的生态位中到达窦状窦外,以接受具有指导性的线索。这些细胞激活特定的转录因子,赋予这些巨噬细胞Kupffer细胞(KC)“同一性”。在血窦中,KCs通过特殊受体从血液中捕获病原体的关键功能。肝纤维化和肝硬化是各种慢性肝病的常见终末期,在受影响的个体中导致大量的发病率和死亡率。尽管病因不同,但进展过程相似,肝细胞死亡和胶原沉积在肝窦周围,导致血流重新分布到新的和扩张的肝内和肝外侧支血管。尚不清楚纤维化重塑如何影响生态位环境KC。
1、活体显像显示肝纤维化的进行性血管重建
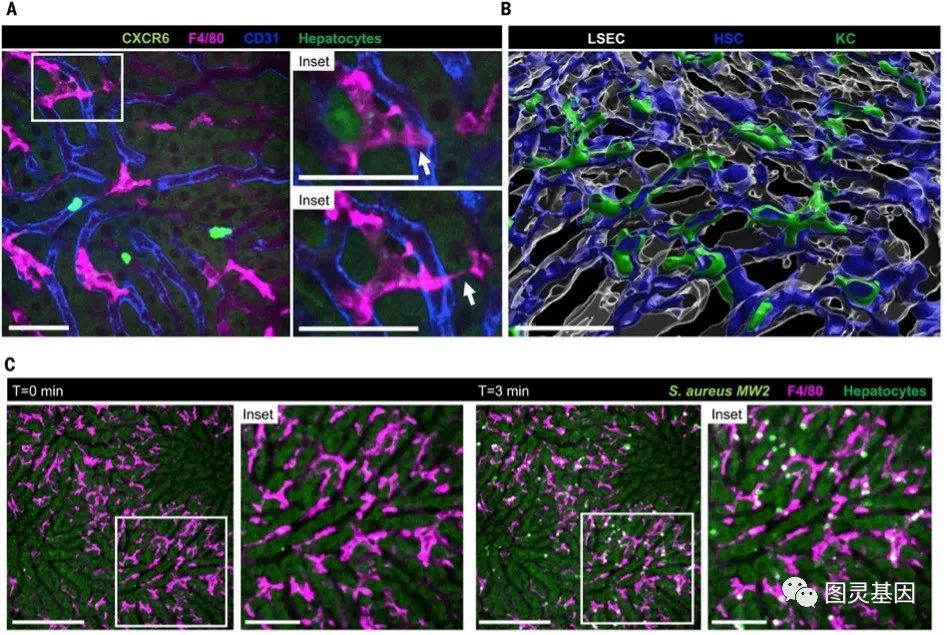
KCs的特征是其分支结构,相对于其他巡逻的免疫细胞而言具有固着性,主要位于血管内(图1A)。与此同时,它们的长突起与肝实质细胞(图1B)包括肝星状细胞,肝窦内皮细胞(LSECs)和肝细胞,共同形成KC生态位。实质细胞和KCs之间的相互作用对KC的功能至关重要,因为实质细胞提供了维持KC身份的重要信号。由于血源性病原体瞬间被KCs捕获,该生态位可用于免疫监测(图1C)。为了让KCs捕获血源性细菌,血窦必须足够狭窄,这样KCs才能在不限制血流通过这些通道的情况下占据大量的窦腔(图1C)。
2、肝纤维化改变KC细胞生态位,导致功能丧失
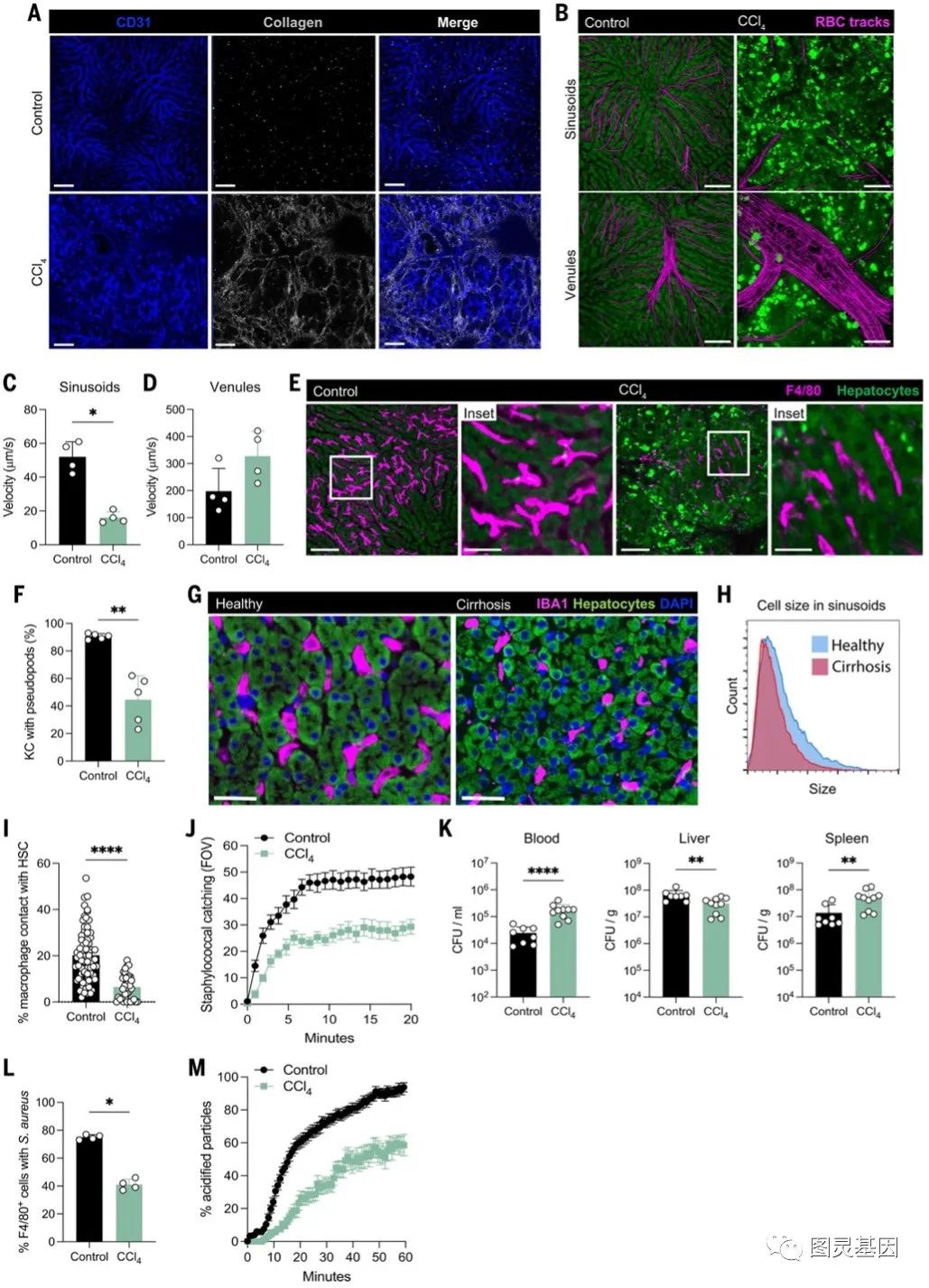
在伴有纤维化的慢性肝病中,无论潜在的病因如何,都会发生结构上的改变,包括窦状窦周围的基底膜沉积(毛细血管化),窦状窦排空,以及肝内和肝外分流和支络的发展以适应血流。使用活体显微镜(IVM),作者发现四氯化碳(CCl4)毒性模型产生了最明显的纤维化和血管变化(图2A)。追踪标记红细胞(rbc)能够定量肝脏血流量(图2B-D)。在对照组小鼠中,均匀的血窦平均流速为52 mm/s,而纤维化小鼠收缩的血窦流速较低。在小静脉中,对照组小鼠的平均流量约为200mm/s,而纤维性小鼠的侧支血管的平均流量为350mm /s(图2B和D)。血流通常是湍流的,而不是层状的(即红细胞不再沿直线运动)(图2D)。
CCL4处理的小鼠的肝窦周围有强劲的胶原沉积 (图2A),小鼠纤维化增加,窦状窦直径减小,巨噬细胞呈细长形状,假足明显减少(图2G、H)。共定位分析证实了在稳态条件下,KCs和造血干细胞之间错综复杂的解剖连接(图2I)。相比而言,CCL4处理的小鼠窦状窦中的大部分KCs与造血干细胞分离(图2I),进一步改变了KC生态位。在对照组小鼠中,绝大多数注射的金黄色葡萄球菌mw2迅速被肝窦中的KCs捕获(图2J)。相比之下,纤维化小鼠窦内的细菌捕获减少(图2J)。CCL4处理小鼠血液和脾脏中的细菌负荷也高于对照组(图2K-L)。
3、肝纤维化导致KC细胞特性丧失
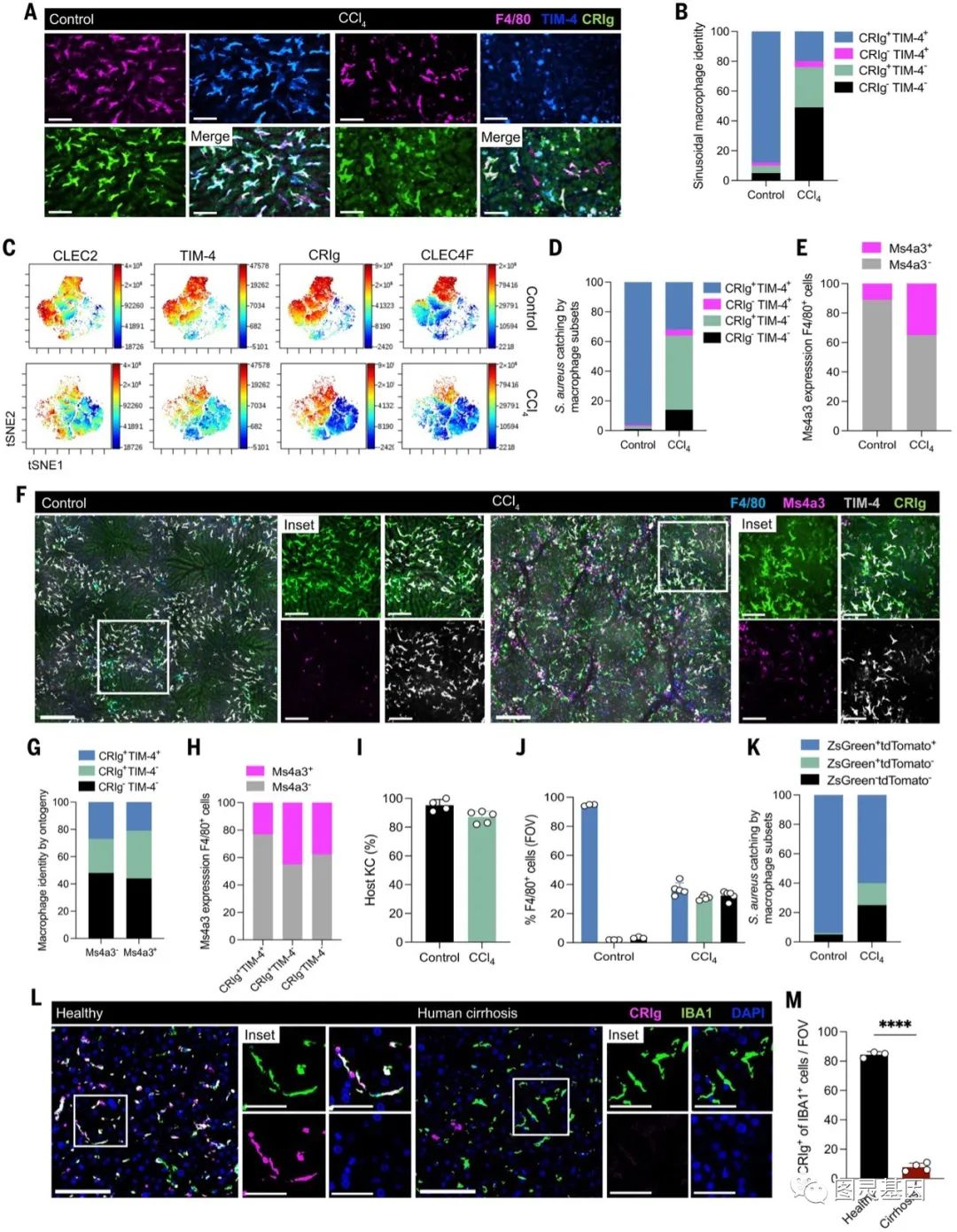
为了纤维化窦内KC腔室的形态学和功能变化促使我们研究表型适应。我们集中研究了两个关键分子——CRIg和TIM-4),这两个分子赋予了KCs功能表型。对照组小鼠肝窦中超过90%的F4/80+巨噬细胞共表达TIM-4和CRIg。相比之下,ccl4处理小鼠中较少的F4/80+巨噬细胞表达TIM-4和/或CRIg(图3A和B)。
对照小鼠中的大多数KCs表达高水平的已知KC识别标记。相比之下,在CCl4处理8周的小鼠中,KCs的所有四种分子水平均较低(图3C)。
在稳态条件下,2-10%的BM衍生单核细胞贡献了肝巨噬细胞池。CCl4处理8周后,窦状窦中约30%的巨噬细胞来自于骨髓来源的单核细胞,70%是胎儿肝脏来源的KC(图3E-F)。超过95%的F4/80+窦类细胞KC表型活跃(图3J)。在CCl4处理过的小鼠中,KC细胞活性下调。肝硬化患者的肝脏活检中也可以看到KC身份的缺失。与健康对照组相比,IBA1+人肝窦巨噬细胞中CRIg缺失(图3L和M)。
4、纤维化中出现多核合胞体,具有KC细胞特征
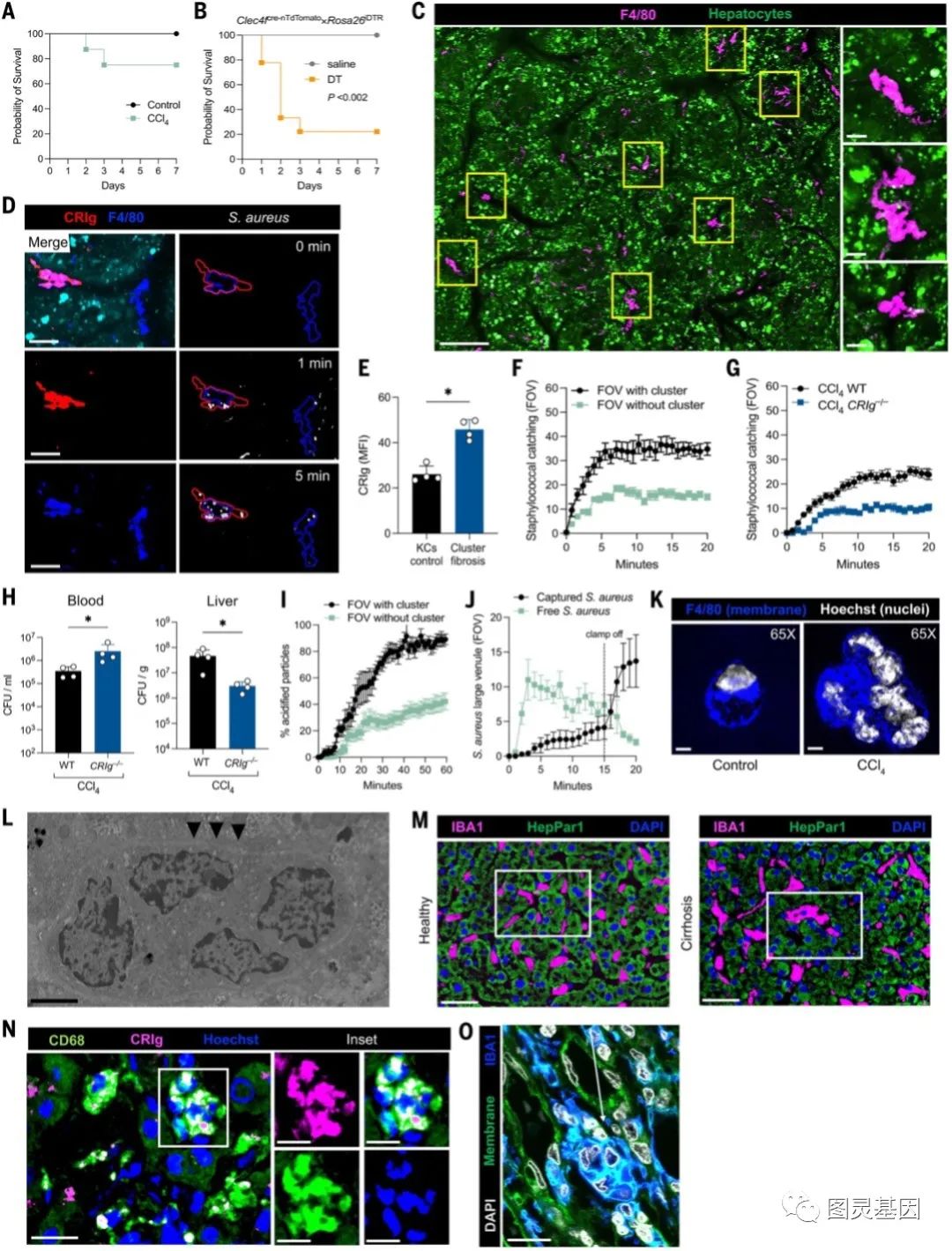
管纤维化肝窦中的KC捕获和杀死能力明显受损,但大多数细菌被该器官捕获(图2K)。此外,金黄色葡萄球菌感染后的总生存期仅存在微小差异。7天内,100%的对照组小鼠存活,而CCL4处理组小鼠存活率为75 - 80%(图4A)。8周时,CCL4处理的小鼠形成大量的F4/80+巨噬细胞聚集,占据了大侧支血管腔的大部分宽度。在较大的图像中,侧支血管似乎有大量的这种簇状细胞,尤其是在分叉处 (图4C)。在CCl4处理8周后,CRIg-/-小鼠也形成巨噬细胞聚集物,但不能捕获细菌(图4G-I)。巨噬细胞聚集物对高流量血管中细菌的这种非常有效的清除,由于肝脏血流的减少而大大减少,并在血流正常化后迅速恢复(图4J)。因此,在纤维化肝脏中,表达CRIg的巨噬细胞簇的出现将肝脏的捕获能力从肝窦转移到侧支小静脉。
高分辨率显微镜(图4K)和透射电镜(图4L)在小鼠纤维化肝脏中发现多核巨噬细胞,表明在某些情况下这些细胞融合成巨细胞。然而,作者的成像揭示了巨噬细胞表型的光谱,范围从单个细胞簇到包括多核巨细胞。因此,作者称这些结构为“KC合胞体”。在三个肝移植中心的多中心方法中,作者系统地评估了人类肝硬化肝组织。在不同病因的肝硬化患者中,包括慢性病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病和胆汁淤积性肝病患者中存在大量CD68+多核巨细胞群(图4M-O)。这些KC合胞体也有CRIg阳性(图4N)。
5、KC合胞体起源于骨髓
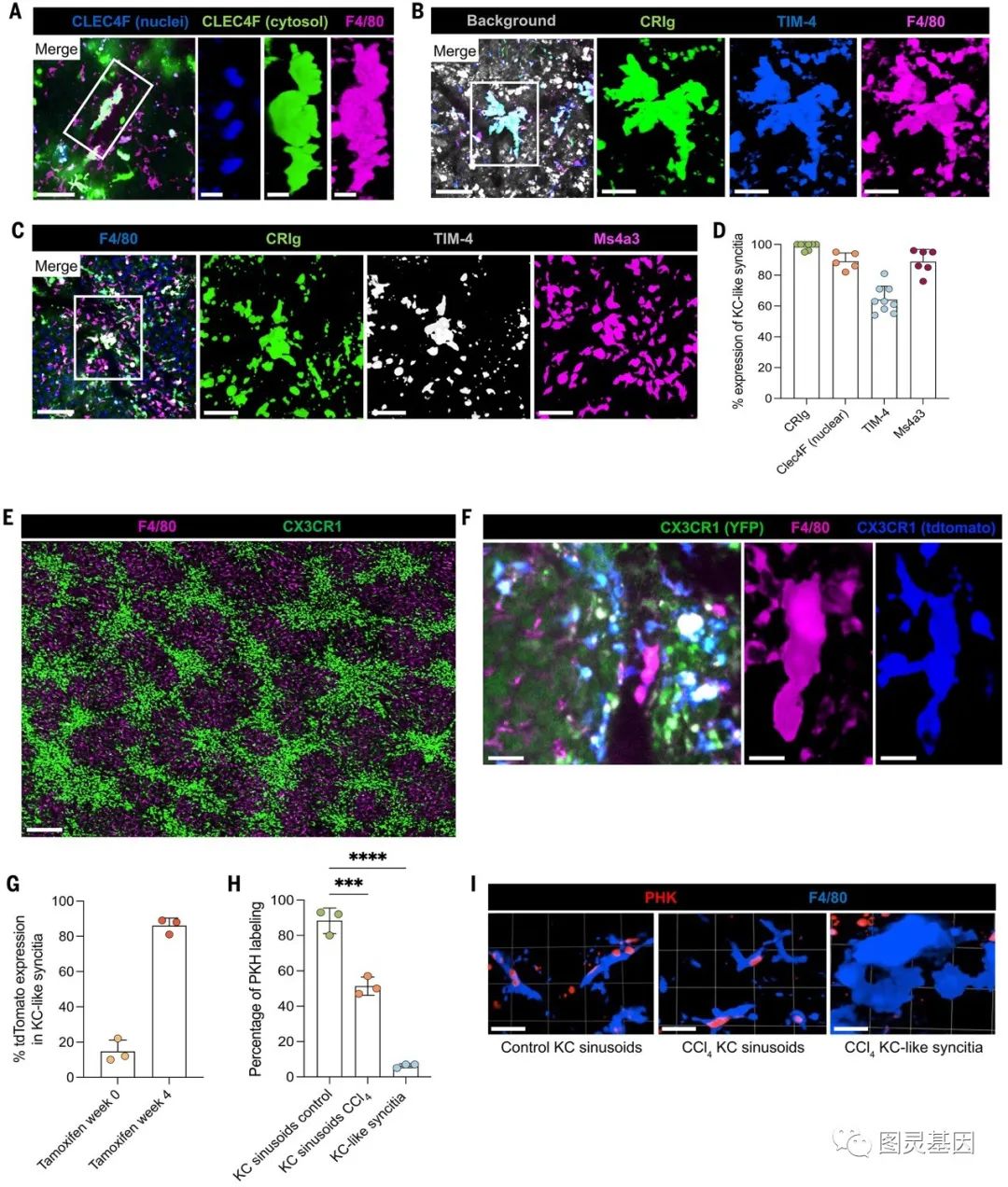
合胞体在血管内的位置、CRIg的高表面表达和优越的细菌捕获能力使其与真正的KCs相似。事实上,IVM显示KC合胞体表达TIM-4和CLEC4F(图5A-D)。此外,KC合胞体与造血干细胞距离较近,造血干细胞已在大侧支周围重新定位。尽管它们具有KC样表型,但约90%的合胞体表达Ms4a3(图5C、D),这与它们最初的单核细胞来源一致。IVM显示,在CCl4治疗2周时,大血管内广泛招募表达cx3cr1的单核细胞,在4周时达到峰值(图5E)。表达Cx3cr1的单核细胞位于大血管,而缺乏Cx3cr1的KC则定位于周围 (图5E)。
6、KC合胞体依赖于清除受体CD36进行细胞粘附和融合
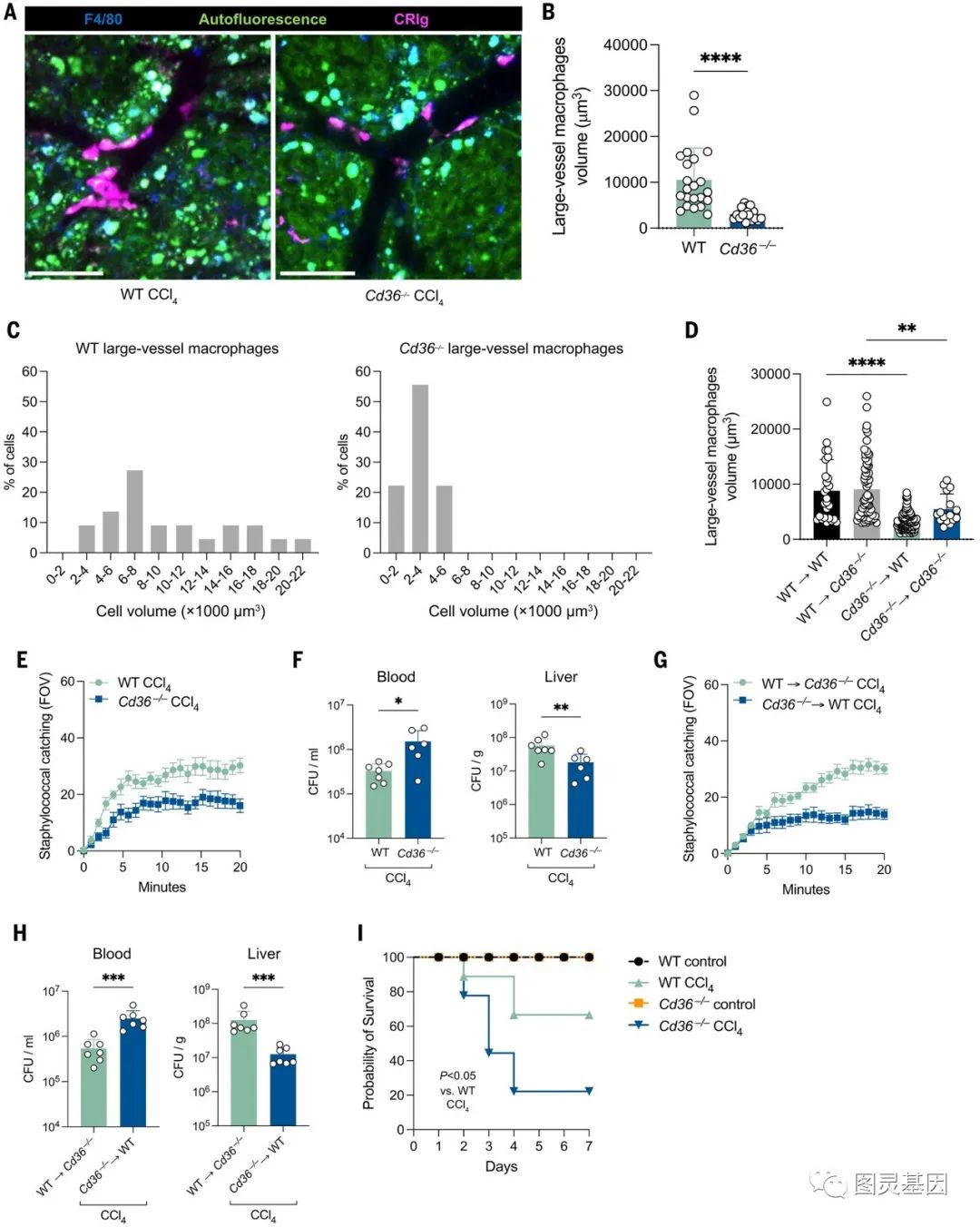
融合和黏附分子Cd9和Cd36在浸润纤维化肝的单核细胞上高表达。Cd36−/−小鼠在给药CCl4后未能形成合胞体,但在侧支血管中仍有大量的CRIg+F4/80+细胞,这表明Cd36−/−单核细胞被招募但未能形成合胞体,而是以分散的个体巨噬细胞的形式出现(图6A)。与KC合胞体相比,单个单核细胞在侧支中的体积要小得多(图6B和C)。KC合胞体的形成只需要BM衍生的CD36(图6D)。接下来,作者测试了Cd36 -/-纤维化小鼠的细菌捕获。CCL4处理的Cd36−/−巨噬细胞缺乏捕获较大血管内细菌的能力(图6E和F)。未接受CCL4的Cd36−/−小鼠,未观察到金黄色葡萄球菌捕获受损。相比之下,CCL4处理的Cd36−/−小鼠在金黄色葡萄球菌处理后的死亡率为80%,而CCL4处理的WT小鼠的死亡率为25%(图6I)。
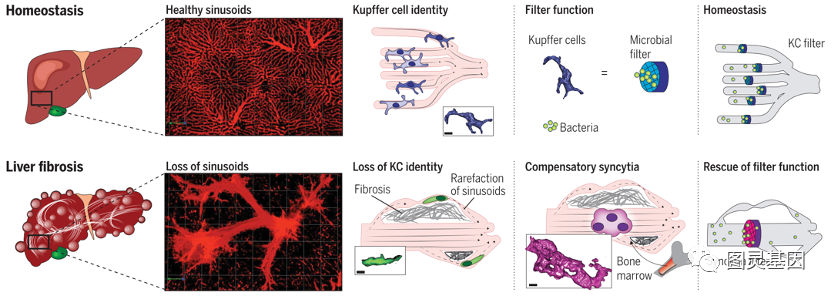
失去与纤维化生态位的实质细胞的接触,导致窦状窦的KCs失去身份和功能。由于在稀薄的血窦中补充KC几乎没有作用,单核细胞跟随绕过血窦的侧支血管的形成,在那里它们形成类似KC的合胞体,有能力从血流中捕获细菌。因此,KC在改变的纤维化生态位环境中的不适应被单核细胞拯救,形成KC样合胞体来捕获细菌。这些细胞结构可能在进化中发挥了关键作用,使哺乳动物能够承受肝脏中严重的慢性损伤。总之,作者的研究结果表明,肝脏的结构重组破坏KC生态位的核心成分,这反过来又推动了免疫重组,这可能是哺乳动物进化的关键部分,肝脏通过免疫重组来应对严重的慢性损伤。



