Nature:PF4在衰老过程中减轻炎症,恢复认知
时间 : 2023-09-15
随着人口老龄化持续加剧,延缓与衰老相关的认知能力下降显得愈发重要。系统性恢复活力的干预措施,如异种共生(年轻和老年动物的循环系统结合),可以逆转老年小鼠在神经发生、突触可塑性和认知功能方面与年龄相关的损伤[1]。然而,尽管返老还童的研究领域正在迅速发展,但年轻动物血液中负责延缓与年龄相关脑损伤的潜在成分仍不清楚。

近日,由美国加州大学旧金山分校Saul A. Villeda和Adam B. Schroer领衔的研究团队在《Nature》期刊发表重要研究成果,他们将老年雄性小鼠暴露于含有血小板的年轻小鼠血浆中,可以在细胞水平上减少海马的神经炎症,并改善海马依赖性认知障碍。血小板来源的趋化因子PF4的循环水平在年轻小鼠中相对于老年者更高。全身给药外源性PF4可以引发突触可塑性相关的分子变化并改善认知。该研究确定了血小板衍生因子作为减轻炎症和挽救老年认知的潜在治疗靶点。
研究人员首先证实了血小板富集在年轻小鼠血浆制剂中(图1a-c)。随后,老龄雄性小鼠24天内静脉注射8次等剂量年轻血浆制剂、年轻血小板组分或生理盐水(图1d)并对海马进行了RNA测序。与对照组相比,年轻血浆制剂和年轻血小板分别导致605和671个基因的差异表达(图1e)。基因本体(GO)分析了重叠的195个差异表达基因(DEGs),发现了与免疫调节和神经系统发育相关的变化(图1f-h)。
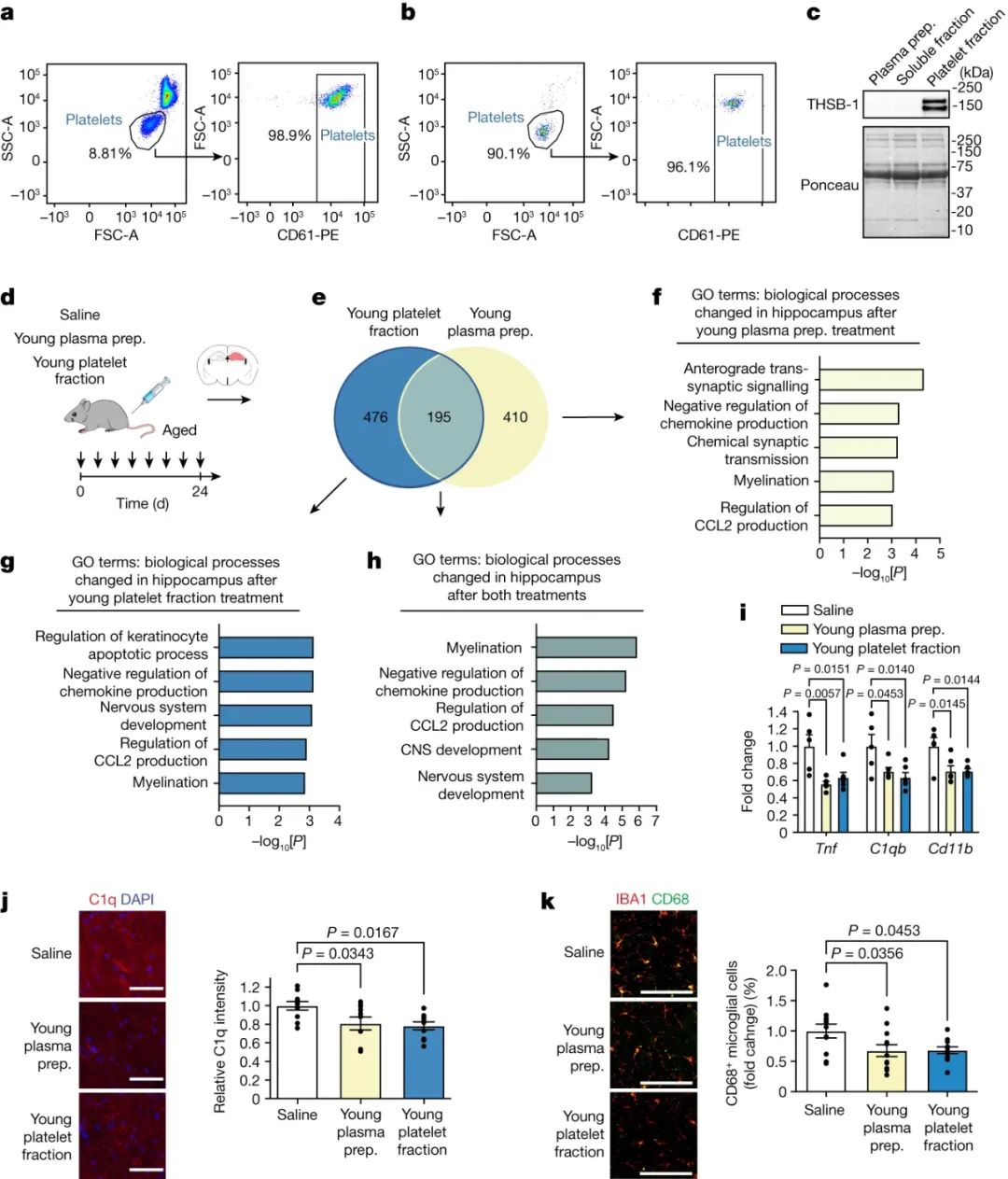
图1 血小板因子减轻老年海马神经炎症
适应性不良炎症是脑老化的一个标志。相应地,团队在一个独立的老年雄性小鼠队列中检测了众多神经炎症标志物。与对照组相比,给予年轻血浆制剂或年轻血小板组分后,检测到促炎细胞因子肿瘤坏死因子(Tnf)、补体引发剂C1qb和小胶质细胞激活标志物CD11b的表达降低(图1i);此外,衰老海马中C1q蛋白水平也相应下调(图1j)。此外,在年轻血浆制剂或年轻血小板组分全身给药后,老年小鼠海马中共表达溶酶体激活标志物CD68的IBA1阳性小胶质细胞水平下降(图1k)。这些结果表明,年轻血浆制剂对老年大脑的益处超出了先前报道的对成人神经发生和突触可塑性的恢复作用[1]。
接下来,研究人员试图找到调节年轻血浆制剂所观察到的有益效果的关键因子。PF4是一种从血小板中释放并参与凝血和免疫调节的趋化因子,与大脑神经发生的有益影响有关[2]。通过Western Blot分析发现,与老年小鼠相比,年轻小鼠的血小板组分中PF4水平较高(图2a),并且基于酶联免疫吸附试验(ELISA),在年轻小鼠的血浆制剂中检测到PF4水平升高(图2b)。此外,与老年健康人相比,来自年轻人血液的富血小板血浆中PF4水平升高(图2c,d)。因此,他们将功能研究的重点放在了PF4上。
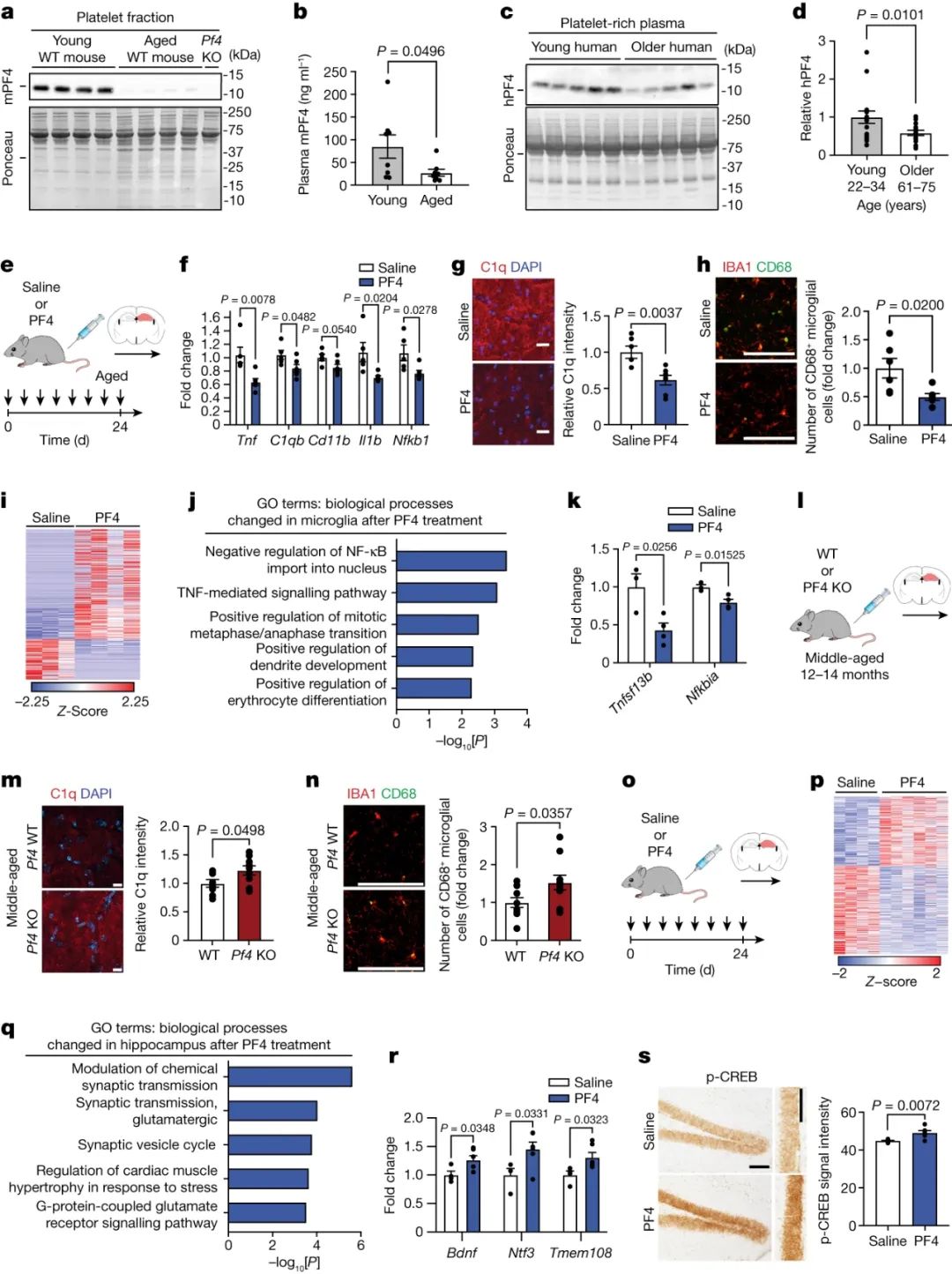
图2 全身性PF4可减轻神经炎症并引发老年海马突触相关变化
为了研究PF4潜在的促青春活性,研究者给老年雄性小鼠全身注射等剂量PF4或生理盐水并评估了老龄小鼠海马的神经炎症(图2e)。结果显示,与生理盐水对照组相比,给予PF4的老年小鼠海马中促炎基因Tnf、Nfkb1和Il1b、补体因子C1qb和小胶质细胞激活标志物CD11b的表达减少(图2f)。此外,免疫组化分析显示,PF4处理后老年小鼠海马中C1q水平降低,活化的CD68+小胶质细胞减少(图2g,h)。为了进一步研究小胶质细胞特异性的分子变化,他们对静脉注射PF4或生理盐水后从老年小鼠海马组织中分离的小胶质细胞进行了RNA-seq分析,发现了346个DEGs(图2i)。氧化石墨烯分析发现了Tnf介导的信号传导的变化(图2j),这是一种促炎信号级联反应,与神经退行性疾病中的突触受损和认知功能障碍有关[3]。PF4治疗也降低了炎症信号的表达(图2k)。紧接着,团队研究了PF4的缺失是否会引起成年海马的神经炎症(图21)。他们观察到,与同龄野生型(WT)小鼠相比,中年PF4敲除(PF4-KO)小鼠海马中C1q水平和CD68+小胶质细胞增加(图2,n)。这些数据表明,全身给药PF4足以减轻老年海马的神经炎症,而PF4的丢失则会加速中年时神经炎症的增加。
为了描述PF4潜在的中枢和外周作用机制,团队评估了PF4穿过血脑屏障的能力。他们生成了编码HiBiT标记版本的PF4的表达结构。HiBiT是一种小肽,它与LgBiT形成复合物,产生发光信号,从而敏感地检测标记蛋白[4]。给老年小鼠注射含有PF4-HiBiT或GFP表达构建体的制剂(HDTVI),HiBiT水平在不同组织中被表征(图3a,b)。血浆和肝脏中检测到发光信号;然而,在注射GFP的老年动物中,大脑中没有检测到高于观察到的信号(图3b)。虽然不能排除PF4在大脑中的直接作用,但这表明其作用机制是外周的。
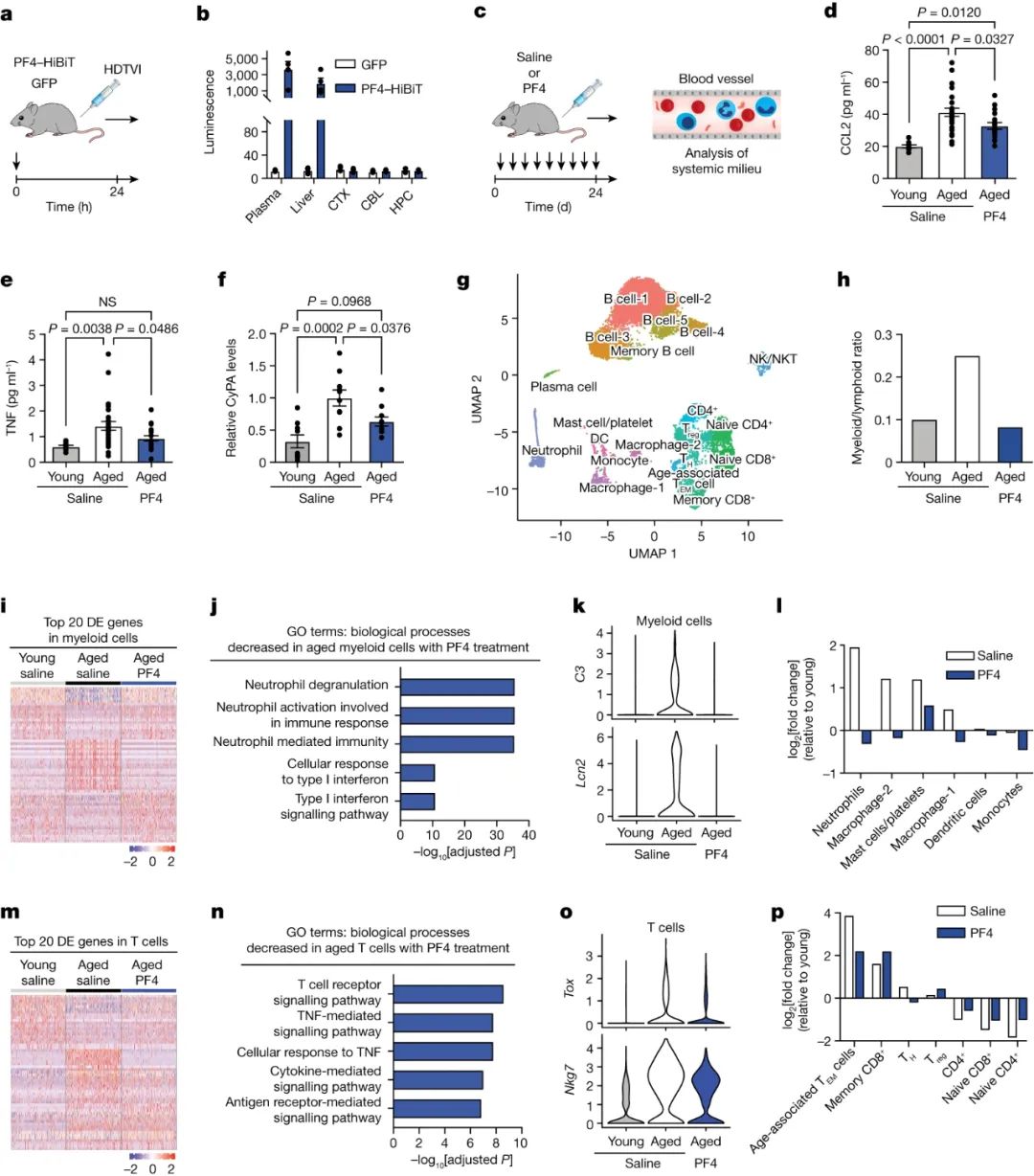
图3 系统性PF4可将老化的外周免疫系统恢复到更年轻的状态
有研究已经证明,衰老的全身环境促进了海马的衰老,部分原因是通过增加全身促衰老免疫因子的水平,如CCL2、CyPA、TNF和β2微球蛋白[5]。因此,他们评估了PF4是否降低了血浆制剂中已知的促衰老免疫因子的水平(图3c),并通过ELISA和Western Blot分析观察到循环CCL2、CyPA和TNF的下降,但没有β2微球蛋白的下降(图3d-f)。这些数据表明,与全身炎症信号的减少是PF4对神经炎症有益作用的潜在中介。
在上述实验的基础上,团队更广泛地研究了全身PF4给药对老年外周免疫系统的影响。使用基于主成分分析(PCA)的方法鉴定了21个细胞簇,并通过UMAP投影到二维图上(图3g)。值得注意的是,与年轻对照小鼠相比,在盐水处理的老年小鼠中观察到的已知与年龄相关的髓样细胞与淋巴样细胞比率的增加,在经PF4处理的老年小鼠中被逆转(图3h)。在髓细胞群中,PF4治疗恢复了更年轻的基因特征(图3i),并降低了炎症信号的表达(图3j-k)。进一步分析显示,PF4处理的老年小鼠的单个骨髓细胞群部分恢复到年轻水平(图3l)。在淋巴细胞群体中,PF4处理将细胞转向年轻的T细胞基因特征(图3m),并降低炎症信号和衰竭标记物的表达(图3n-o)。此外,PF4治疗使衰老的T细胞群恢复到更年轻的水平(图3p)。这些数据表明,PF4在一定程度上将老化的外周免疫系统的细胞组成和分子特征恢复到更年轻的状态。
基于以上发现,研究人员推断,在全身给药血小板因子后,与年龄相关的神经炎症的减少,同时循环促衰老免疫因子水平的降低和衰老外周免疫系统的恢复可能会改善老年小鼠的认知能力。因此,他们在静脉注射年轻血浆制剂、年轻血小板组分或生理盐水后,使用新对象识别(NOR)、强迫交替Y迷宫和情境恐惧条件反射评估了海马依赖的学习和记忆(图4a)。在NOR和Y迷宫测试中,使用年轻血浆制剂或年轻血小板组分处理的老年小鼠相对于熟悉的条件,对新物体有偏好,而对照组小鼠则没有表现出偏好(图4b,c)。在记忆测试中,全身给药年轻血浆制剂或年轻血小板增加了情境性冻结行为(图4d)。
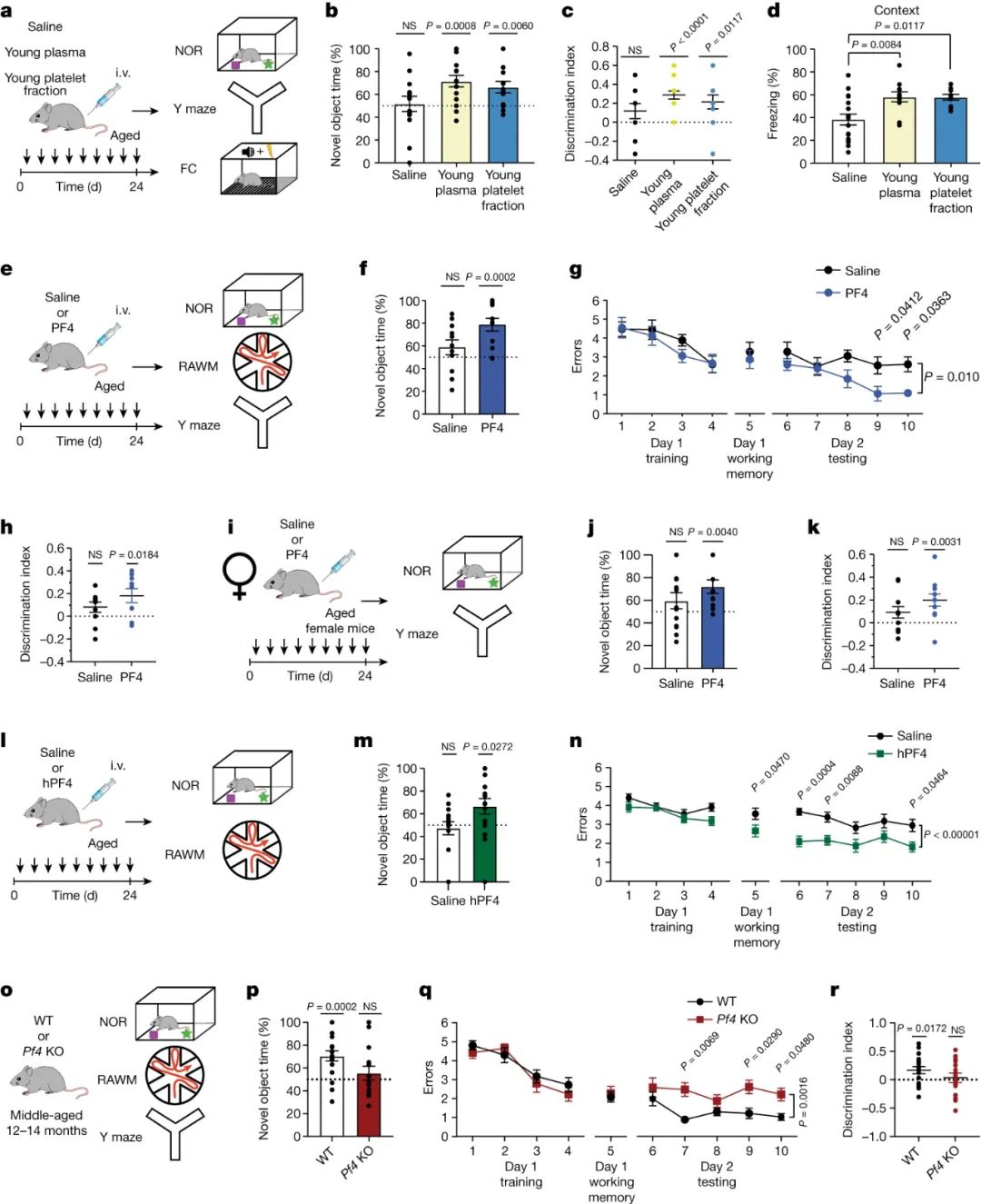
图4 系统性PF4改善老年小鼠海马依赖性认知功能
接下来,他们使用NOR、Y形迷宫和桡臂水迷宫(RAWM)研究了全身给药PF4对海马依赖性学习和记忆中年龄相关认知障碍的潜在有益影响(图4e)。在NOR和Y迷宫测试中,PF4处理的老年小鼠相对于熟悉的条件,对新物体有偏好,而盐水处理的小鼠则没有(图4f,h)。在RAWM的训练阶段,所有小鼠都表现出相似的空间学习能力(图4g)。然而,在任务的测试阶段,与对照老龄小鼠相比,给予PF4的老龄小鼠对平台位置的学习和记忆有所改善(图4g)。至此,行为分析确定了PF4对老年认知功能的改善(图4i-k)。
为了研究PF4的转化潜能,老龄雄性小鼠全身注射了取自人血小板的人PF4 (hPF4),并使用NOR和RAWM测试评估海马依赖的学习和记忆(图4l)。与熟悉的物体相比,hPF4处理的老年小鼠更倾向于新物体,而盐水处理的小鼠则没有表现出偏好(图4m)。所有小鼠在RAWM训练中表现出相似的空间学习能力(图4n)。然而,在任务的测试阶段,与经盐水处理的老龄小鼠相比,给予hPF4的老龄小鼠对平台位置的学习和记忆有所改善(图4n)。
最后,团队研究了PF4的缺失是否会在与年龄相关的认知衰退的典型发病之前对认知产生负面影响。使用NOR、Y迷宫和RAWM测试评估成年和中年PF4-KO小鼠海马依赖性学习和记忆(图4o)。在NOR和Y迷宫测试中,中年对照小鼠相对于熟悉的条件仍然偏向于新物体,而中年PF4-KO小鼠不再表现出这种偏好(图4p,r)。在RAWM训练中,所有小鼠都表现出相似的空间学习能力(图4q)。然而,在任务的测试阶段,中年PF4-KO小鼠表现出对平台位置的学习和记忆受损(图4q)。这些行为数据表明,全身给药PF4可增强老年小鼠的认知功能,而PF4的丧失则会以年龄依赖性的方式加速小鼠的认知能力下降。
总之,该研究发现血小板衍生的趋化因子PF4是一种促进年轻的因子,可以减轻与年龄相关的神经炎症,引发突触可塑性相关的分子变化,并挽救老年小鼠海马依赖的学习和记忆。考虑到炎症增加与年龄相关的神经退行性疾病之间的密切联系,该研究进一步提高了血小板因子的有益作用可能更广泛地应用到老年痴呆相关疾病治疗的可能。



